発表のポイント
・クライオ電子顕微鏡による構造解析により、ヒト由来ゴルジ体膜局在型カルシウムポンプSPCA1aの高分解能構造を世界で初めて決定した。
・SPCA1aが、小胞体カルシウムポンプSERCAと類似した立体構造変化を介してカルシウムイオンを輸送する機構を解明した。
・SPCA1aが、カルシウムイオンだけでなく、マンガンイオンに対しても輸送活性を有するメカニズムを分子構造レベルで明らかにした。
概要
SPCA1aはゴルジ体(注1)内にカルシウムを輸送するカルシウムポンプです。SPCA1aの機能不全がHailey-Hailey病(注2)などの皮膚疾患を引き起こすことが知られている一方で、ゴルジ体のカルシウムの生理機能については十分に理解されていません。SPCA1aは、カルシウムイオンに加えて、マンガンイオンを輸送することも報告されています。しかしながら、これまでSPCA1aの高分解能構造がなかったため、その金属イオン輸送機構は未解明でした。
東北大学多元物質科学研究所の陳 正豪 研究員、渡部 聡 助教、稲葉 謙次 教授(生命科学研究科、理学研究科化学専攻 兼担)、がん研究会の大学 保一 プロジェクトリーダー、および東京大学大学院医学系研究科の吉川 雅英 教授らを中心とした共同研究グループはクライオ電子顕微鏡単粒子解析(注3)を用いて、カルシウム結合型、マンガンイオン結合型、および金属イオン解離型のヒト由来SPCA1aの高分解能構造を世界で初めて決定しました。その結果、SPCA1aがカルシウムイオンまたはマンガンイオンと同じポケットで結合し、巧妙な立体構造変化を介することで、これら金属イオンを選択的に輸送する機構の一端が解明されました。以上の研究成果は、SPCA1aの変異が引き起こす疾患の分子構造レベルでの原因解明にもつながると期待されます。
本研究成果は、2023年3月3日14時(米国東部時間)に米国雑誌Science Advances誌に掲載されました。
詳細な説明
研究の背景
ゴルジ体は細胞内小器官の一つで、小胞体の下流に位置します。小胞体で合成され立体構造を形成した分泌タンパク質はゴルジ体に輸送され、糖鎖修飾などの加工を受けます。そのためゴルジ体は、小胞体と同様にタンパク質工場の一つと考えられ、タンパク質の立体構造形成や種々の酵素の活性に必要なカルシウムイオンがゴルジ体内には高濃度で保存されています。過去の研究において、小胞体膜局在型カルシウムポンプであるSERCAの高分解能構造が多くの中間状態について決定され、そのカルシウム輸送のメカニズムの詳細が明らかにされました。一方ゴルジ体膜局在型カルシウムポンプであるSPCA1aの構造と分子機構に関する知見はSERCAと比べて乏しく、十分な理解には至っておりませんでした。しかしながらSPCA1aとSERCA間でアミノ酸配列の類似性が高いことから、SPCA1aもSERCAと同様に、ATP分子依存的にカルシウム輸送活性があると考えられてきました。またSPCA1aはカルシウムイオンに加えマンガンイオンも輸送する活性があることを示すデータが報告されていました。このように、SPCA1aはSERCAよりも広範囲の金属イオン輸送活性を有すると考えられ、SPCA1aがカルシウムイオンやマンガンイオンをゴルジ体内に輸送するメカニズムについて、分子構造レベルでの解明が長く待たれていました。
今回の取り組み
本研究では、ヒト由来SPCA1aの高分解能構造をクライオ電子顕微鏡単粒子解析法により決定することに成功しました。はじめにSPCA1a単独での構造解析を試みましたが、SPCA1aのサイズがクライオ電顕解析を行うのに十分でなかったため、高い分解能のデータが得られませんでした。そこで酵母表面ディスプレイ法(注4)と呼ばれる手法を用いて、SPCA1aと特異的に結合するナノボディ(注5)を作製し、SPCA1aとナノボディの複合体の状態でクライオ電顕構造解析を行いました。東京大学大学院医学系研究科に設置されているハイエンドクライオ電子顕微鏡装置Titan Krios (ThemoFisher製)、及び東北大学未来型医療創成センターに設置されているハイエンドクライオ電子顕微鏡装置CRYO ARM 300 (JEOL製)を用いてデータ収集を行ったところ、カルシウムイオンとATP分子が結合している状態については3.1 Å分解能で、マンガンイオンとATP分子が結合している状態については3.2 Å分解能で、ATPが加水分解しリン酸基のみが結合している状態については3.3 Å分解能でそれぞれ構造決定を行いました。得られた構造から、Aドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、10本の膜貫通ヘリックス(N末端からTM1~TM10と呼ぶ)構成されるSPCA1aの全体構造が明らかになりました(図1)。そして、SPCA1aでは、カルシウムイオンとマンガンイオンが同じイオン結合ポケットを共有するものの、SERCAはカルシウム結合サイトが二つある一方で、SPCA1aは一つの金属イオン結合サイトしかもたないことが判明しました(図2上)。さらに、SPCA1aのTM6が結合する金属イオンに依存して動き(図2下)、そのことがSPCA1aの広い金属選択性に寄与する可能性が示唆されました。以上の知見は、ゴルジ体におけるカルシウムイオンおよびマンガンイオン恒常性維持機構について、分子構造レベルでの理解の大きな一助となるものです。
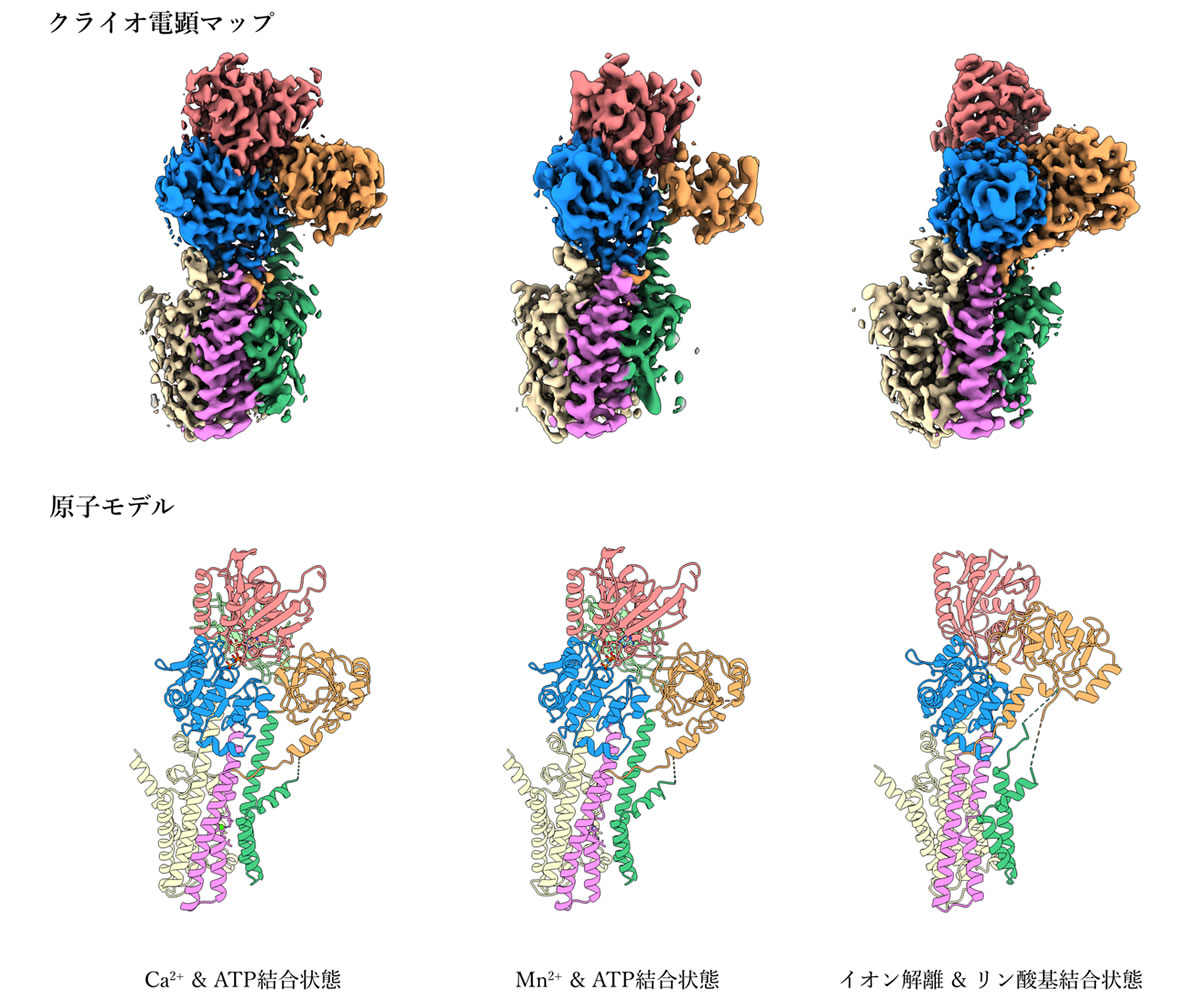
図1. SPCA1aの三つの中間状態のクライオ電子顕微鏡マップと分子構造モデル
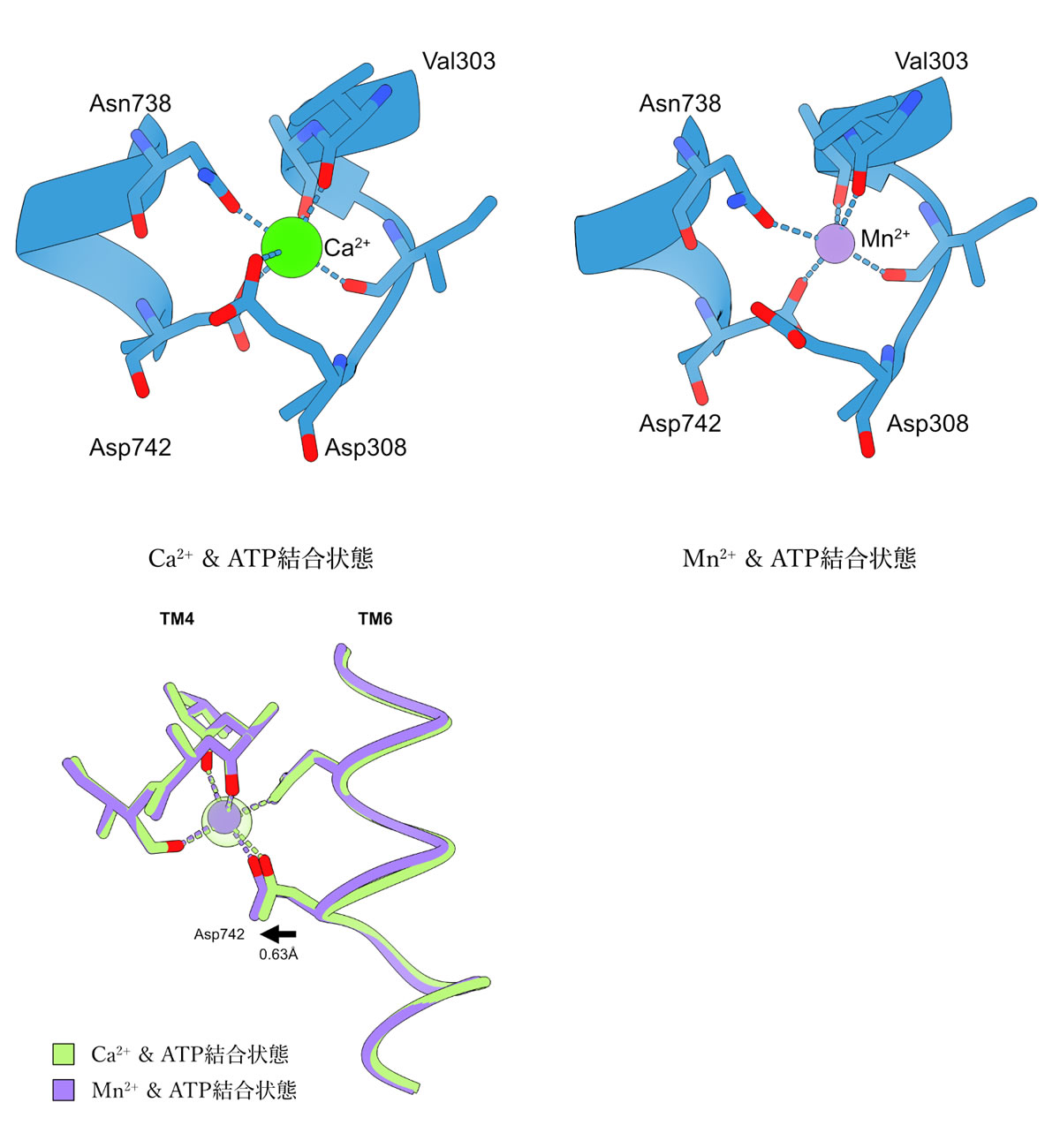
図2 SPCA1aにおけるカルシウムイオン(左上)とマンガンイオン(右上)の結合様式、およびマンガンイオン結合に伴うTM6の動き(下)
今後の展開
本研究において、SPCA1aのカルシウムとATPが結合した状態、マンガンとATPが結合した状態、さらには金属イオンが解離しATPの加水分解が起こった後の状態について、世界で初めて高分解能構造解析に成功しました。しかしながら、SPCA1aが駆動するカルシウム・マンガン輸送サイクルの全容を深く理解するには、これら三つの状態以外の中間状態についても、構造情報を得る必要があります。さらに、得られた構造情報を用いて分子動力学計算などを行うことにより、反応サイクルにおけるSPCA1aの動きを原子レベルでより詳細にみる必要があります。
興味深いことに、SPCA1 をコードする遺伝子ATP2C1上の変異が、希少皮膚疾患である Hailey-Hailey 病(HHD)を引き起こすことが知られています(図3)。HHDとATP2C1の相関は2000年に遺伝子解析によって明らかにされていますが、その分子構造レベルでの理解には至っておりませんでした。本研究で得られた知見は、細胞内カルシウム・マンガン恒常性維持機構の解明のみならず、希少皮膚疾患のHHDの原因解明につながることが期待されます。さらに、SPCA1aによるマンガンイオンの過剰な取り込みが、パーキンソン病に類似した症状を引き起こすことも報告されています。本研究において、カルシウム結合型とマンガン結合型のSPCA1aの高分解能構造が解かれたことで、SPCA1aによる選択的金属イオン輸送の制御機構の一端が明らかとなり、創薬の可能性も含め、医学的にも有用な知見が得られたと考えられます。
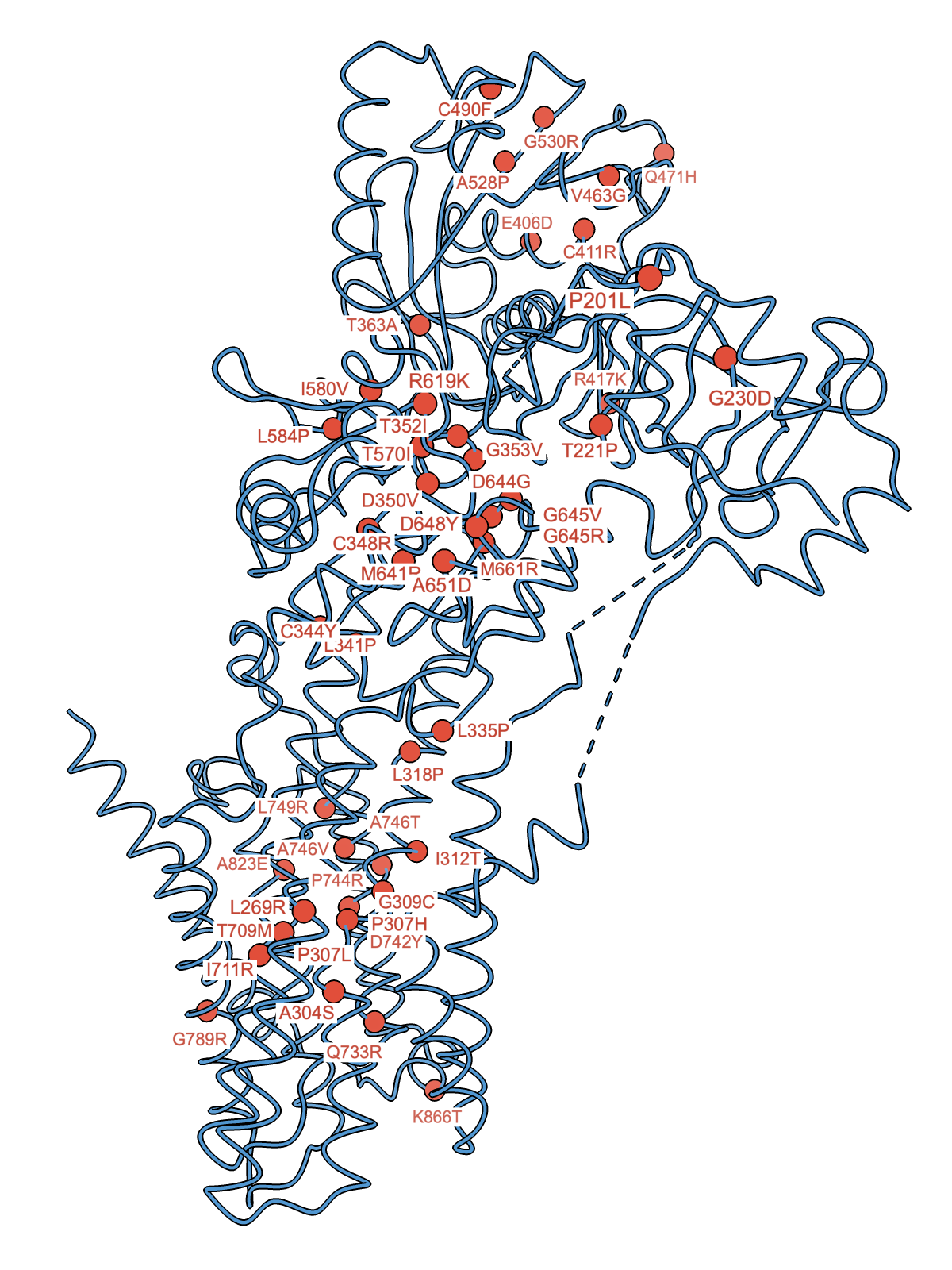
図3 Hailey-Hailey病に関わるSPCA1aの変異部位(赤丸が変異箇所を示す)
謝辞
本成果は、以下の事業・研究課題の支援によって得られました。
■ 日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
課題名:ケミカルプロテオスタシス:レドックス、pH、金属イオンが織りなすタンパク質品質管理機構の研究開発
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21gm1410006h0001
■ 日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)
課題名:クライオ電顕による細胞内ネイティブ複合体構造解析
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP19am0101115
■ 学術振興会科学研究費補助金学術変革領域(A)「クロススケール新生物学」
・課題名:クロススケール細胞内分子構造解析が解明する小胞体恒常性維持機構
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21H05253
・課題名:クロススケール In-cell cryo-ET技術の開発と上皮組織への応用
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP21H05248
用語説明
注1.ゴルジ体
細胞内小器官の一つであり、小胞体から輸送されてきた分泌タンパク質の糖鎖修飾や金属イオン配位などを行う。ゴルジ体で加工を受けた分泌タンパク質は、さらに下流の区画へ輸送され、最終的に細胞膜または細胞外に到達する。ゴルジ体も、小胞体と同様にカルシウム濃度が高く保たれているが、小胞体のカルシウム濃度は0.5 ~ 1ミリモーラーであるのに対し、ゴルジ体のカルシウム濃度は 0.1 ミリモーラー程度である。
注2.Hailey-Hailey病
家族性良性慢性天疱瘡とも呼ばれ、わきの下や股などに水ぶくれができる皮膚病であり、指定難病の一つである。SPCA1 をコードする遺伝子ATP2C1の変異によって起こる病気であるが、くわしい発病の仕組みは完全に解明されていない。
注3.クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築することができる。
注4.酵母表面ディスプレイ法
酵母ディスプレイまたは酵母表面ディスプレイは、酵母の細胞壁に組み込まれた組換えタンパク質の発現を利用して、対象分子と特異的に結合する抗体の単離や操作をするタンパク質工学の手法。
注5.ナノボディ
アルパカやラクダ、ラマなどラクダ科の哺乳類は、生体内で軽鎖の無い、重鎖のみから成る抗体を産生することが知られている。この抗体から、抗原を認識する最小のタンパク質断片を遺伝子工学的に切り出したもの。
論文情報
“Cryo-EM structures of human SPCA1a reveal the mechanism of Ca2+/Mn2+ transport into the Golgi apparatus”
Science Advances
Chen, Z., Watanabe, S., Hashida, H., Inoue, M., Daigaku, Y., Kikkawa, M., and *Inaba, K.
*責任著者:東北大学多元物質科学研究所 教授 稲葉 謙次
DOI:10.1126/sciadv.add9742
URL:https://doi.org/10.1126/sciadv.add9742
関連リンク:
公益財団法人がん研究会
東北大学
東北大学大学院理学研究科・理学部
東北大学大学院生命科学研究科
生体分子構造研究分野(稲葉謙次研究室)
問い合わせ先
東北大学 多元物質科学研究所
教授 稲葉 謙次(いなば けんじ)
Tel: 022-217-5604
E-mail: kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
公益財団法人がん研究会 調達・社会連携部 広報課
Tel: 03-3570-0775
E-mail: ganken-pr*jfcr.or.jp(*を@に置き換えてください)