発表のポイント
・DNA結合タンパク質Nhp6A注1がDNA上で3種類のDNA結合タンパク質をすり抜けて移動できることを発見
・DNA上にタンパク質渋滞を起こし、DNA結合タンパク質のDNA上での動きを単分子レベルで追跡
概要
DNA結合タンパク質は、細胞内にあるDNAの中から結合すべき標的部位を探索し、そこに結合して機能を発揮します。DNA上に他のDNA結合タンパク質がいない場合、DNA結合タンパク質はDNAに沿って自由に移動できます。しかし、細胞内では、様々なDNA結合タンパク質がDNAに結合し、DNA上で渋滞が起こります。では、このタンパク質渋滞時に、DNA結合タンパク質はどのようにDNA上で働くのでしょうか?
東北大学多元物質科学研究所の鎌形清人准教授とカリフォルニア大学ロサンゼルス校のReid C. Johnson教授らの研究グループは、DNA結合タンパク質がDNA上のタンパク質渋滞をすり抜けてDNAに沿って移動できることを発見し、その仕組みを解明することに成功しました。
本成果は、遺伝子治療などで使われるであろう「ゲノム編集DNA結合タンパク質」の機能向上などに役立つと期待されます。
本研究は、科学研究費助成事業の支援を受けて実施され、2020年11月4日に英国科学誌 Nucleic Acids Research に掲載されました。
プレスリリース本文(PDF)
研究背景
DNA結合タンパク質は、細胞内にあるDNAの中から結合すべき標的部位を探索し、そこに結合して機能を発揮します。DNA上に他のDNA結合タンパク質がいない場合、DNA結合タンパク質はDNAに沿って自由に移動できます。ここで、DNA結合タンパク質を車、DNAを道路に例えてみましょう。実際の細胞内では、様々なDNA結合タンパク質がDNAに結合しているため、道路はたくさんの車で込み合い、渋滞が起こります。では、このタンパク質渋滞時に、DNA結合タンパク質はどのようにDNA上で働くのでしょうか?
研究の成果
研究グループは、3種類のDNA結合タンパク質(Fis注2, Nhp6A, HU注3)を用いてDNA上に渋滞を引き起こし、蛍光修飾したNhp6Aの動きを、単分子蛍光顕微鏡を用いて追跡しました(Fig. 1)。観察したいDNA結合タンパク質のみを蛍光修飾することで、単分子レベルでの観察が可能になります。Nhp6AがDNA上を移動する距離を計測し、隣接する渋滞タンパク質間の距離と比較しました。その結果、Nhp6Aは、隣接する渋滞タンパク質間の何倍もの距離をDNAに沿って移動できることが分かりました。これは、Nhp6Aが、DNA上で渋滞しているDNAタンパク質をすり抜けていると考えられます。使用した渋滞タンパク質Fis, Nhp6A, HUは、立体構造、大きさ、DNAとの結合様式が異なりますが、Nhp6Aはこの3種類のDNA結合タンパク質をすり抜けることも明らかとなりました。さらに、粗視化分子動力学シミュレーションによって、Nhp6Aは、特定の構造をとらない天然変性領域でDNAに結合しながら、渋滞を引き起こすタンパク質の脇をすり抜けていることが分かりました(Fig. 2)。言い換えれば、Nhp6Aは、バイクのように車の渋滞の脇をすり抜けることができると考えられます。以上より、DNA結合タンパク質がDNA上でのタンパク質渋滞をすり抜ける現象を発見し、その仕組みを解明することに成功しました。今後、得られた知見は、遺伝子治療などで使われるであろう「ゲノム編集DNA結合タンパク質」の機能向上などに役立つと期待されます。
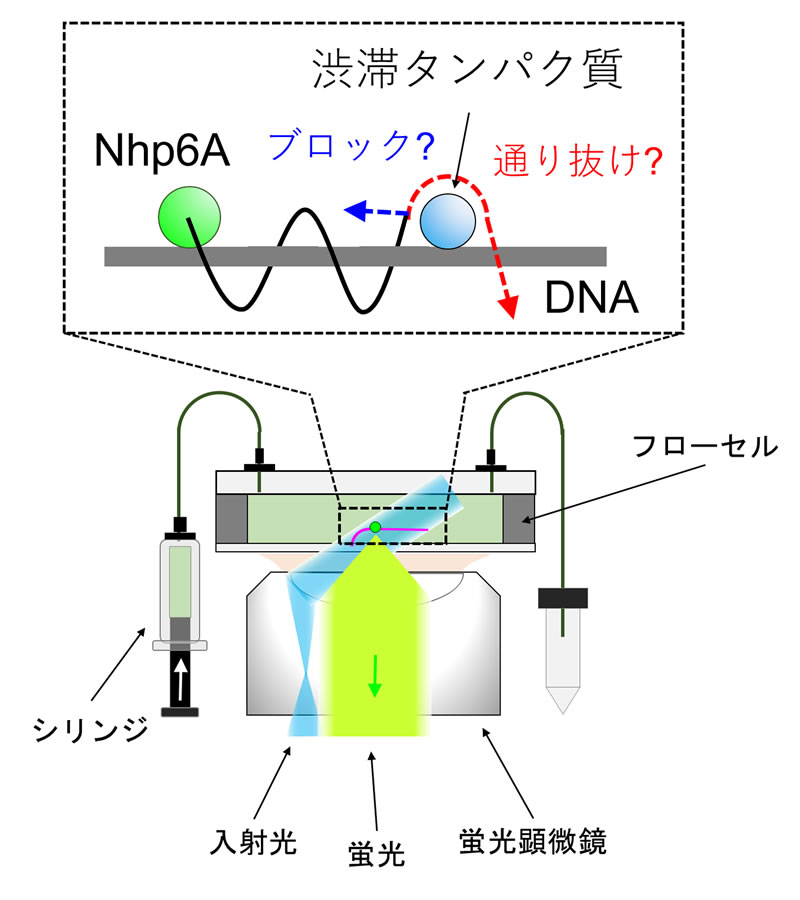
Fig.1 DNA結合タンパク質のDNA上での動きの単分子計測。蛍光顕微鏡にフローセルを設置し、488 nmのレーザー光でフローセル内のDNA結合タンパク質Nhp6Aを照明し、蛍光を検出します。渋滞を引き起こすDNA結合タンパク質(渋滞タンパク質、青色の丸)をDNA(灰色の棒)上に配置し、Nhp6A(緑色の丸)が渋滞タンパク質をブロックするか、通り抜けるかを検証しました。原著論文の図1を改変し、転載しました。
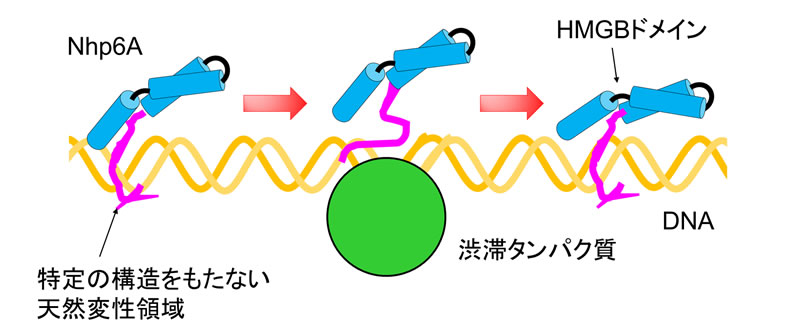
Fig.2 Nhp6AがDNA上で渋滞タンパク質をすり抜ける運動の模式図。Nhp6Aは、特定の構造をもたない天然変性領域(ピンク)でDNA(オレンジ)につかまり、渋滞タンパク質(緑)の脇をすり抜ける。原書論文のデータを参考に、模式図を作成した。
論文情報:
“The HMGB chromatin protein Nhp6A can bypass obstacles when traveling on DNA”
Kiyoto Kamagata1,2,3*, Kana Ouchi1,2, Cheng Tan4, Eriko Mano1, Sridhar Mandali5, Yining Wu1,3, Shoji Takada6, Satoshi Takahashi1,2,3, and Reid C. JohnsonM5,7*
所属:1.東北大学 多元物質科学研究所, 2.東北大学大学院 生命科学研究科, 3.東北大学 理学部化学科, 4.理化学研究所 計算科学研究センター, 5.カリフォルニア大学ロサンゼルス校 デビッドゲフィン医学部, 6.京都大学 理学研究科生物科学専攻, 7.カリフォルニア大学ロサンゼルス校 分子生物学研究所
Nucleic Acids Research 48, 19, 10820-10831 (2020)
DOI:10.1093/nar/gkaa799
用語解説
注1) DNA結合タンパク質Nhp6A
Nhp6Aは、酵母のタンパク質で、HMGBドメインと呼ばれる構造領域と特定の構造をもたない天然変性領域を使い、DNAに結合します。Nhp6Aは、DNAへの結合に伴いDNAを曲げ、DNAループ構造をつくり、他のDNA結合タンパク質の機能を補助します。
注2) DNA結合タンパク質Fis
Fisは、大腸菌のタンパク質で、ヘリックス―ターン―ヘリックスモチーフと呼ばれる構造領域を使い、DNAに結合します。Fisも、DNAへの結合に伴いDNAを曲げ、他のDNA結合タンパク質の機能を補助します。
注3) DNA結合タンパク質HU
HUは、大腸菌のタンパク質で、βアームと呼ばれる構造領域を使い、DNAに結合します。HUも、DNAへの結合に伴いDNAを曲げ、他のDNA結合タンパク質の機能を補助します。
関連リンク:
東北大学ウェブサイト
生命分子ダイナミクス研究分野(高橋聡研究室)
問い合わせ先
東北大学多元物質科学研究所
准教授 鎌形 清人(かまがた きよと)
電話: 022-217-5843
Email:kiyoto.kamagata.e8*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学多元物質科学研究所 広報情報室
電話: 022-217-5198
E-mail:press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)