北海道大学
東北大学
ポイント
- 金ナノ構造の分子サイズの狭い隙間にタンパク質を効率良く誘導する技術を新たに開発。
- タンパク質1分子を検出可能な超高感度センシング基板であることを実証。
- 微量サンプルからのバイオマーカー検出による疾患の早期発見に向けた進展に期待。
北海道大学電子科学研究所(東北大学多元物質科学研究所兼務)の三友秀之准教授、居城邦治教授、同大学大学院生命科学院博士後期課程の高 天旭氏らの研究グループは、タンパク質を超高感度で検出する新技術を開発しました。
ナノメートルサイズの金属構造体を利用して、物質の化学構造に特有のシグナルであるラマン散乱*1を増強し、分子を同定する手法は表面増強ラマン散乱*2法として知られています。この方法では、金属ナノ構造体のナノサイズの狭い隙間に入り込んだ分子から発生するシグナルが最も強く、これによって微量分子の高感度検出が可能になります。しかし、従来の技術では、サイズが大きなタンパク質のような生体高分子を狭い隙間に効率的に導入することが困難でした。
本研究で新たに開発したGFT(ゲルフィルタートラップ)法は、ゲルが膨潤するときに外部から水を吸収する力を利用してタンパク質をゲルの表面に誘導し、ゲルの網目構造によってゲルの表面にタンパク質を捕捉します。この方法を三角形プレート状金ナノ粒子の集合体を載せたゲルに適用すると、粒子の間隙にタンパク質が効率良く導入され、超高感度での検出が可能になりました。このブレークスルーは、特に医療応用において、1滴以下の体液から様々な生体高分子を簡便に検出するシステムの開発に寄与し、生体センシング技術の分野における大きな進展が期待されます。
なお、本研究成果は、2024年8月2日(金)公開のACS Nano誌に掲載されました。また、今回の研究成果が高く評価され、本研究が掲載誌の表紙に選出されました。
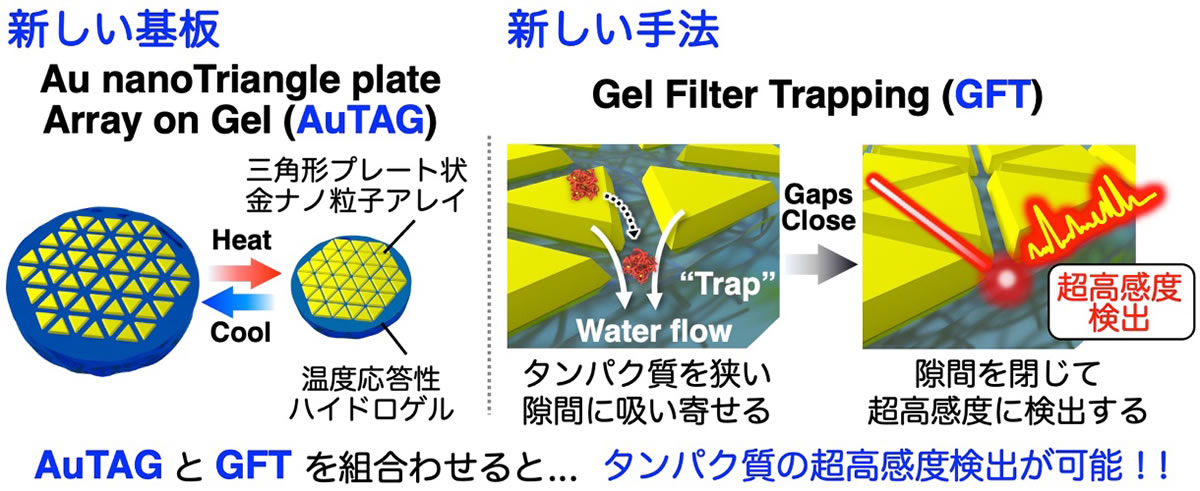
三角形プレート状金ナノ粒子が配列した構造体を温度応答性ハイドロゲルの上に載せて、ナノ構造を制御可能な新しい基板を開発した。さらに、ゲルの吸水力と3次元網目構造によりタンパク質を効率良く粒子間のナノギャップ部位に導入し、ギャップを閉じることで超高感度検出を達成した。
背景
現在、様々な疾患に関連するバイオマーカー*3が次々と明らかになっています。これらのバイオマーカーを簡便かつ高感度に検出することができれば、日々の健康状態の確認、疾患の早期発見につながり、健康で健全な社会が達成できると期待されます。そのため、これまで様々なバイオマーカーの検出方法が開発されてきました。生体物質の判別を可能にする手法として、ラマン分光法*4があります。ラマン散乱は分子構造に応じたスペクトル(分子の指紋ともいえる情報)を与えるため、分子の同定を可能にする検出方法です。ラマン分光法における課題は検出感度の低さでした。ここで、金属ナノ構造体が光照射下で発現する局在表面プラズモン共鳴*5現象(ナノ構造体近傍に形成される増強電場)を利用すると、ラマン散乱の強度を著しく増強できることが知られており、この効果を利用した表面増強ラマン散乱法の開発が注目されてきました。これまで、色素や農薬などの低分子化合物の測定において、その有用性が実証されてきましたが、タンパク質やDNAのような生体高分子の検出ではその効果を十分発揮できていない状況でした。
研究手法・成果
研究グループではこれまで、金ナノ粒子の自己組織化*6膜とハイドロゲルを複合化することで、ナノ粒子集合化膜の粒子間距離を動的に制御するシステムを開発し、表面増強ラマン散乱の高感度検出法の開発に取り組んできました。本研究では、まずナノ粒子の構造の最適化を行い、より高い増強電場の形成を可能にしました。具体的には、三角形プレート状粒子を合成し、表面修飾を施した後、水面上で自己組織化膜を形成させ、固体基板上に移し取りました(図1)。その結果、三角形ナノ粒子が高密度にきれいに並んだものが得られました(図2a)。この構造は、三角形の頂点が集まる部分に空隙を形成します(図2b)。また、電磁場計算を行った結果、この頂点が集まった部位で非常に強い増強電場が得られることも確認されました(図2c)。この数nmの空隙に、うまくタンパク質を導入することができれば、高感度なタンパク質の検出が可能になります。そこで、この狭い空隙に効率的にタンパク質を導入するための新しい手法(ゲルフィルタートラップ(GFT)法)を開発しました。得られたナノ粒子膜を温度に応答して大きさが変わるハイドロゲルの上に載せました(図3)。ハイドロゲルの大きさが変わるとき、ゲルは水を吸い込んだり吐き出したりします。その吸水する力を利用して、タンパク質を粒子の間に引き込みました(図4)。ゲルは網目構造を有しているため、吸い寄せられたタンパク質はゲルの表面で捕捉されます。その後、ゲルを縮めて粒子間距離を狭め、ラマン散乱測定を行いました。その結果、1滴以下(15 µL)の量の様々なタンパク質溶液から、それぞれの分子に依存したラマンシグナルを高感度に得ることに成功しました。pg/mL の超希薄な濃度で測定を行うと、測定領域にタンパク質が1分子あるかないかという条件になり、1分子のタンパク質からシグナルを検出することもできることが確認されました。また、ハンディタイプの検出器を用いても十分な検出が可能であることも確認されました。この結果から、すべての生体高分子を簡便かつ高感度に検出可能なシステムになることが想定されます。
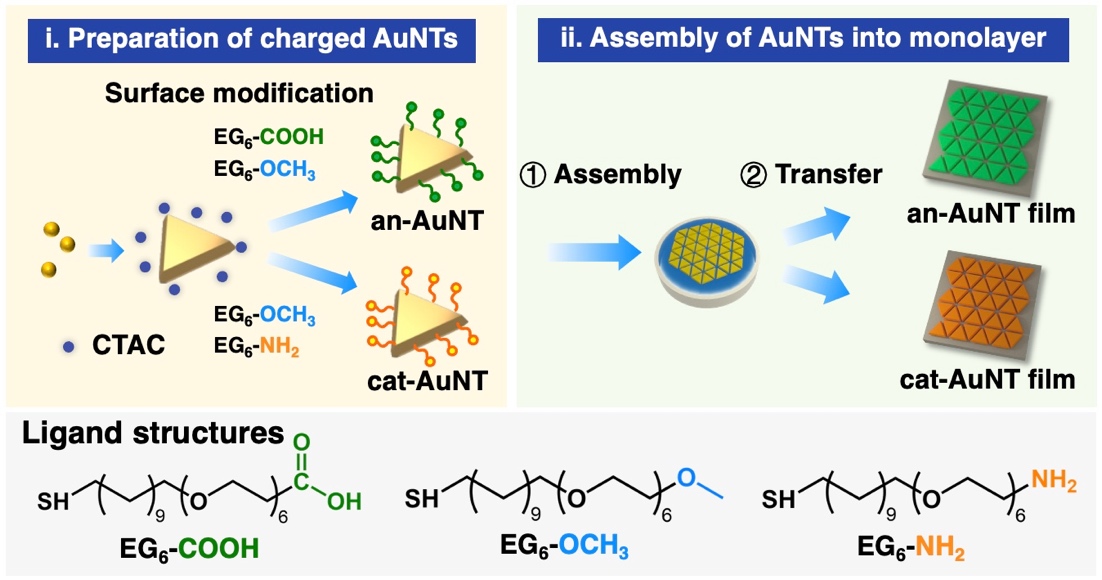
図1.三角形プレート状金ナノ粒子自己組織化膜の作成方法。i) 種粒子の異方成長を利用して三角形プレート状金ナノ粒子を合成し、オリゴエチレングリコールを有するアルカンチオール分子で粒子の表面を被覆した。タンパク質の吸着を抑制するため、アニオン性とカチオン性の電荷を有する基板を作製した。ii) 粒子を有機溶媒に分散させ、水面に展開することで自己組織化膜を形成し、固体基板上に移し取った。この基板上に移し取ったナノ粒子薄膜をハイドロゲルの表面に載せ替えた。
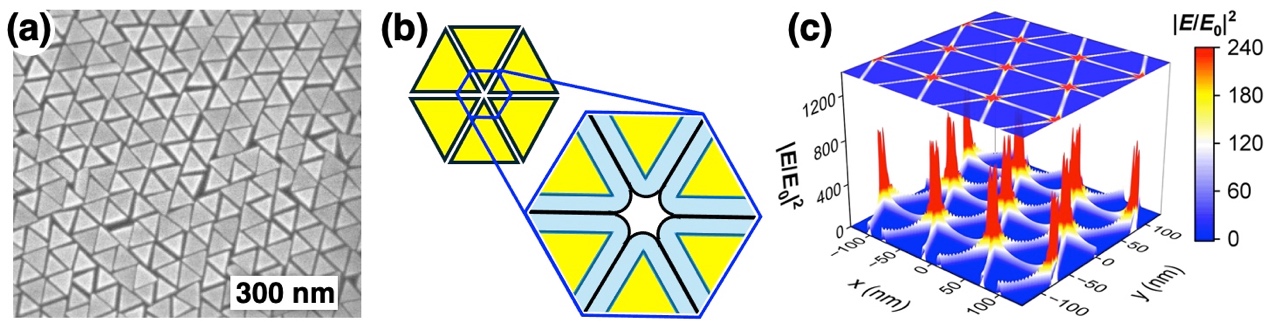
図2.a) 三角形プレート状金ナノ粒子自己組織化膜の電子顕微鏡像。b) 有機分子で表面を被覆された三角形プレート状金ナノ粒子のイメージ図。c) 三角形プレート状金ナノ粒子自己組織化膜におけるラマン散乱測定で使用する785 nm の光照射時の電場増強効果の電磁場計算の結果。
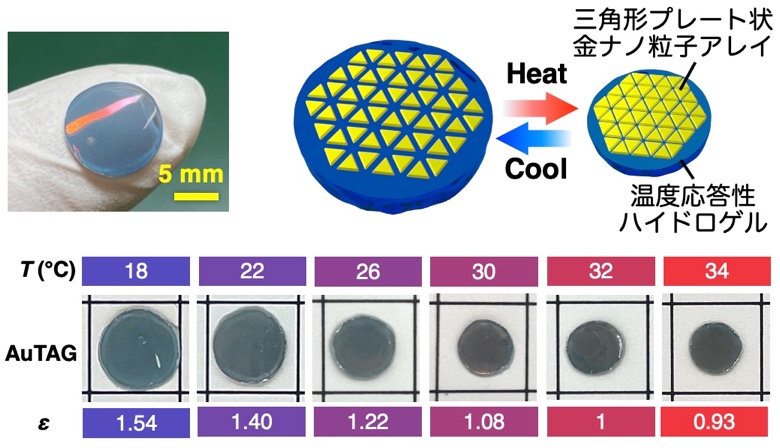
図3.三角形金ナノ粒子自己組織化膜を載せたハイドロゲルの写真と温度に応答したサイズ変化。
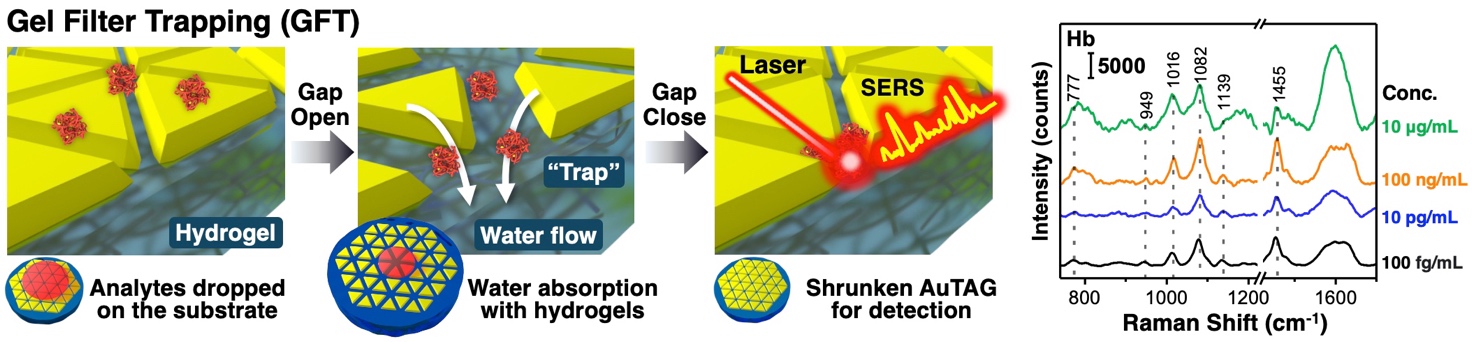
図4.ゲルフィルタートラップ法の概要図(左)とヘモグロビンの表面増強ラマン散乱測定の結果(右)。
今後への期待
実際の体液(血液や唾液)などを試料として、疾患や健康状態を調べるためのバイオマーカーの検出システムへの応用が期待されます。
謝辞
本研究は、⽂部科学省科学研究費助成事業(JP23K04902、JP18H05205、JP23H05464、JP19H05627、 JP18H01804、JP19H00845、JP21H01736、JP22K09942、JP19H04209)、JST科学技術イノベーション創出に向けた大学フェローシップ創設事業(JPMJFS2101)、日本学術振興会助成金「物質・デバイス領域共同研究拠点」の共同研究プログラム、文部科学省助成金「マテリアル先端リサーチインフラ」事業(JPMXP1222HK0105、JPMXP1223HK0051)の⽀援を受けて実施されました。
用語解説
*1 ラマン散乱 … 入射光と分子振動の相互作用によって、入射光とは異なる振動数の光が散乱される現象のこと。
*2 表面増強ラマン散乱 … 貴金属表面において、光照射時に形成される局在表面プラズモンによる増強電場において、分子が発するラマン散乱が増強される現象のこと。いかに強い増強電場を形成するかが、ラマン散乱を利用した分子検出において重要とされている。
*3 バイオマーカー … ある疾患の有無や進行状態を示す目安となる生理学的指標のこと。血液中に存在する生体物質の種類や濃度などが該当する。
*4 ラマン分光法 … 分子の化学構造によって変化する入射光とラマン散乱の振動数差を振動数ごとに分光し、その強度をプロットしたラマンスペクトルといい、その計測をラマン分光法と呼ぶ。ラマンスペクトルは、その物質の化学構造に由来する「分子の指紋」とも呼ばれる情報を与えるため、分子の特定に有効である。
*5 局在表面プラズモン共鳴 … 光の波長以下のサイズの金属ナノ構造に特定波長の光を照射すると、金属粒子内の自由電子の集団的な振動が起こり、ナノ粒子中(表面)にプラズモンが閉じ込められた状態になる。これを局在表面プラズモン共鳴と呼ぶ。粒子はプラズモン共鳴周波数の光を吸収し、粒子表面近くで強い電場が形成される。
*6 自己組織化 … 物質や個体が、個々の自律的な振る舞いの結果として、秩序を持つ大きな構造を作り出す現象のこと。物質を規則だった配列に並べる手法として、材料開発において重要な手法である。
論文情報
An Ultra-sensitive Surface-Enhanced Raman Scattering Platform for Protein Detection via Active Delivery to Nanogaps as a Hotspot
(ナノギャップ部位への高効率導入技術によるタンパク質の超高感度な表面増強ラマン散乱検出技術)
高 天旭1、谷地赳拓2、石 旭2,3、佐藤梨奈4、佐藤主税5,6,7,8、与那嶺雄介2、蟹江澄志4,9、三澤弘明2,10,11、居城邦治2、三友秀之2,4(1北海道大学大学院生命科学院、2北海道大学電子科学研究所、3北海道大学創成研究機構、4東北大学多元物質科学研究所、5産業技術総合研究所筑波中央第7群、6青山学院大学理工学研究科、7筑波大学グローバル教育院、8日本大学医学部微生物学・粘膜免疫/共生微生物、9東北大学国際放射光イノベーション・スマート研究センター、10岡山大学異分野基礎科学研究所、11国立陽明交通大学)
ACS Nano(ナノ化学の専門誌)
DOI:10.1021/acsnano.4c09578
公表日:2024年8月2日(金)(オンライン公開)




問い合わせ先
北海道大学電子科学研究所
准教授 三友秀之(みともひでゆき)
(東北大学多元物質科学研究所 兼務)
TEL:011-706-9370
Email:mitomo*es.hokudai.ac.jp(*を@に置き換えてください)
URL:https://chem.es.hokudai.ac.jp
(報道に関すること)
北海道大学社会共創部広報課
TEL:011-706-2610、TAX:011-706-2092
Email:jp-press*general.hokudai.ac.jp(*を@に置き換えてください)
東北大学多元物質科学研究所広報情報室
TEL:022-217-5198
Email:press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)