国立大学法人東北大学
学校法人日本医科大学
発表のポイント
- 光を当てると構造が変化する分子(フォトクロミック化合物)を用いて、細胞内の蛋白質の局在や相互作用を自在に操作する技術を開発しました。
- 細胞質に存在する酵素をミトコンドリアへ移動させることで、ミトコンドリアを選択的に分解するマイトファジー(注1)を引き起こす細胞内シグナル伝達を調節できる技術です。
- パーキンソン病を含む神経変性疾患の疾患機序の解明への貢献が期待されます。
概要
顕微鏡で観察しながら、光を当てて生体分子や細胞の機能を操作する技術は、生命や疾患の仕組みを理解するための革新技術として大きな注目を集めています。
東北大学多元物質科学研究所の小和田俊行准教授、水上進教授らの研究グループは、日本医科大学先端医学研究所の山本林教授らとの共同研究で、光で色や構造が変化するフォトクロミック化合物(注2)と呼ばれる分子を用いて、生きた細胞内の蛋白質の局在を迅速かつ定量的に操作する技術を開発し、マイトファジーの分子機構の解明のために応用しました。
本研究成果は、パーキンソン病などの神経変性疾患をはじめとする様々な疾患の機構解明につながることが期待されます。
本研究成果は、2024年6月18日18 時(日本時間)に、科学誌 Nature Chemical Biology にオンライン公開されました。
研究の背景
細胞内の生命現象は、蛋白質のような生体分子の局在や分子間相互作用などによって時空間的に制御されています。そのため、蛋白質の細胞内局在を人為的に操る技術は、細胞機能に関わる蛋白質の役割を理解するために有効な方法の一つです。現在、そうした目的で用いられる技術には2つあり、1つが光応答性蛋白質を用いる光遺伝学(注3)的手法であり、もう1つが低分子化合物を用いるChemically Induced Dimerization(CID)法(注4)です(図1)。

図1. 蛋白質の二量化と解離を制御するための既存の手法:光遺伝学的手法(左)とケージドCID法(右)
光遺伝学的手法では、光を吸収すると構造が変化する蛋白質が用いられますが、ほとんどの場合は青色光を吸収すると二量体を形成するフラビン蛋白質が用いられています。これらの蛋白質は光照射を止めると二量体が解消されるため、二量体を維持するためには青色光を連続照射する必要があり、照射時間が長時間に渡る場合には細胞への光毒性が懸念されます。
フィトクロムB(PhyB)とフィトクロム相互作用因子(PIF)からなるPhyB/PIFシステムでは、波長の異なる2種類の光によって二量体の形成と解離の双方向制御が可能ですが、蛋白質のサイズが大きい(99 kDaと11 kDa)などの問題もあり、細胞内蛋白質の二量体形成を高い時間分解能で制御するには限界がありました。一方、低分子化合物を用いるCID法では、それぞれの蛋白質に結合する二つのリガンド部位を持つ化学二量化剤が用いられます。
近年では、光切断可能な保護基で結合活性を一次的に抑え、光照射で二量化を誘導できるケージドCID法が開発され、細胞内蛋白質の動態を光で制御する新しい技術として注目されています。しかし、ケージドCID法は、光遺伝学的手法とは異なり、原理的に二量化・解離を繰り返すことができないという技術的な制約がありました。
今回の取り組み
本研究では、波長が異なる光を交互にあてることで、蛋白質の二量化と解離を繰り返し制御可能な「フォトクロミックCID法」を世界で初めて開発しました。フォトクロミックCID法は、eDHFR(18 kDa)とHaloTag(34 kDa)と呼ばれる二種類の蛋白質タグ、ならびにそれらを光照射で二量化・解離させるフォトクロミック二量化剤(pcDH)から構成されます(図2)。

図2. フォトクロミック二量化剤pcDHの構造と、フォトクロミックCID法の模式図
pcDHは、細胞を培養したディッシュに添加すると、細胞内に発現させたHaloTag蛋白質と速やかに共有結合します。pcDHの構造中にはeDHFRに結合するフォトクロミック化合物構造が含まれており、光を当てる前および緑色光を照射した場合はE体(トランス体)として存在しています。この状態ではeDHFRへの親和性は低いため、HaloTagとeDHFRは二量体を作りません。
一方、紫色光を照射するとpcDHはZ体(シス体)となり、eDHFRに対する結合親和性が高まり、eDHFRとHaloTagの二量化が起こります。この機構は何度も繰り返し可能で、紫色光と緑色光による二量化と解離の可逆制御が可能になりました。
次にこのシステムを用いて、蛋白質の細胞内局在の光制御を検討しました。ヒト由来細胞の細胞質にeDHFRと近赤外蛍光蛋白質の融合蛋白質(eDHFR-miRFP670nano)を発現させ、細胞内の様々な局所(細胞膜・核・ミトコンドリア外膜・小胞体膜)にHaloTagと橙色蛍光蛋白質の融合蛋白質(Halo-mOrange2)を発現させました。
細胞培養液にpcDHを添加してHaloTagを標識した後、蛍光顕微鏡で観察しながら紫色光をあてたところ、細胞質中のeDHFR-miRFP670nanoが、HaloTagを発現させた局所に速やかに移行しました(図3)。ここに緑色光をあてると、eDHFR-miRFP670nanoは再び細胞質へと拡散しました。紫色光による二量化と緑色光による解離に必要な半反応時間はそれぞれ0.78秒と0.3秒未満であり、報告されている光遺伝学的手法よりも高速に制御できることがわかりました。さらに、紫色光と緑色光を同時にあてたところ、二種類の光の強度比に応じて二量化の程度を精密に制御することができました。このような定量的制御は、フォトクロミックCID法が持つ迅速性と可逆性によって達成できた特性だと言えます。
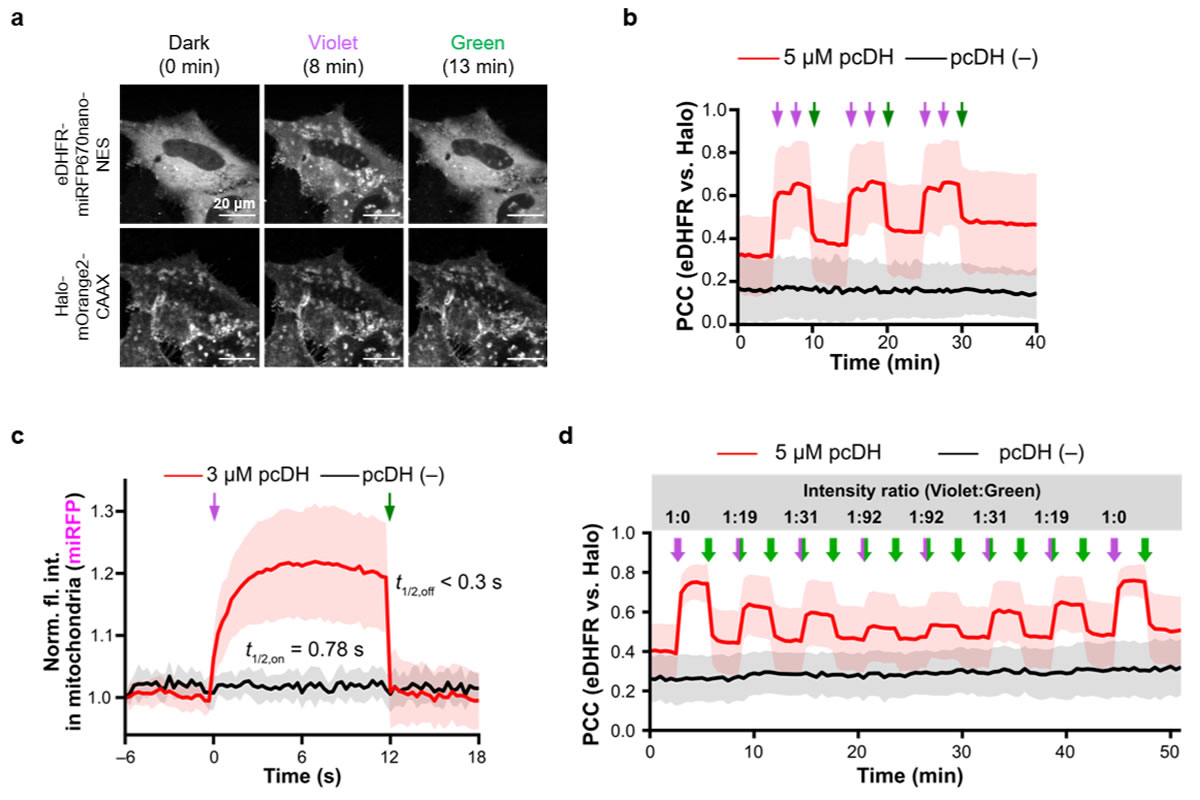
図3. フォトクロミックCID法による細胞内蛋白質局在の光制御実験
(a)eDHFR-miRFP670nano-NES(細胞質)とHalo-mOrange2-CAAX(細胞膜)を発現させたHeLa細胞の共焦点蛍光顕微鏡画像。紫色光の照射によりeDHFRがHaloTagを発現させた細胞膜に移行し、続く緑色光照射により再び細胞質に拡散する様子が観察されました。
(b)aの実験から算出されたeDHFRとHaloTagの共局在度(PCC: ピアソンの相関係数)の時間変化。高いPCC値は共局在度が高いことを意味しています。矢印のタイミングで各波長の光を照射しました。
(c)蛋白質の二量化と解離の速度解析。
(d)紫色光と緑色光を異なる強度比で同時照射した際の蛋白質局在度の変化。
最後に、細胞内シグナル伝達の分子機構解明に対するフォトクロミックCID法の有用性を検証するために、マイトファジーの光操作に応用しました。マイトファジーの初期過程では、損傷したミトコンドリア上にリン酸化酵素PINK1が集積し、ミトコンドリア蛋白質上のユビキチン等のリン酸化により下流にシグナルを伝達することが知られています。しかし、マイトファジーの進行にどの程度のPINK1の蓄積量や係留時間が必要かについては不明な点がありました。
そこで、eDHFRとPINK1の触媒ドメインの融合蛋白質(cytPINK1-mOrange2-eDHFR)を細胞質に、同時にHaloTag(Halo-OMP25)をミトコンドリア外膜上に発現させた細胞を用いました。pcDHを投与した後、紫色光をあててPINK1をミトコンドリア外膜上に係留し、一定時間の経過後に緑色光をあてて再びPINK1を細胞質に拡散させました。PINK1の係留時間とマイトファジーの進行の相関を調べたところ、10分以上の係留時間でマイトファジーの進行が加速されることがわかりました(図4)。

図4. フォトクロミックCID法を用いたマイトファジーの光誘導 (a)PINK1の触媒ドメイン(cytPINK1)のミトコンドリア上への係留により誘導されるマイトファジーの模式図 (b)cytPINK1の係留時間に依存したマイトファジー進行の検証。ミトコンドリアのマトリクスに発現させた蛍光蛋白質(pSu9-mEGFP)とParkinとの共局在度(PCC)を算出し、Parkinのミトコンドリア上への動員度合いをマイトファジー進行の指標として用いました。 (c)cytPINK1をミトコンドリア上に10分間係留した際の蛍光顕微鏡画像と、cytPINK1およびParkinのミトコンドリア局在度の時間変化。
これらの結果から、マイトファジーの進行には、PINK1がある程度の時間ミトコンドリア上に存在し続ける必要があることがわかり、マイトファジーのシグナル伝達にはある閾値を越えると活性化することで、一過性の環境変化等には影響を受けにくいようなシステムの堅牢性が備わっていることが示唆されました。
今後の展開
細胞内シグナル伝達経路における個々の構成因子を操作してメカニズムを理解するためには、時間的・空間的な制御に加えて、定量的な制御も極めて重要になります。本研究で開発したフォトクロミックCID法は、蛋白質の細胞内局在を迅速、可逆的かつ定量的に制御できる点で世界最高レベルの技術と言えます。
本研究では、リン酸化酵素PINK1の局在制御に基づくマイトファジーの光誘導を達成しましたが、局在を制御する標的蛋白質として様々な酵素を用いることで、リン酸化だけでなく様々な翻訳後修飾による細胞内シグナル伝達を精密に制御できると考えられます。したがって、本技術はマイトファジーの分子機構解明だけでなく、他の生命現象やがん・神経変性疾患をはじめとする様々な疾患の発症機構を分子レベルで理解するための強力な技術になることが期待されます。
謝辞
本研究は、文部科学省・日本学術振興会科学研究費補助金(JP19H05284、 JP21H05252、JP20K05702、JP23H02077、JP21H05256)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)(21gm1410006h0001)、武田科学振興財団、中谷医工計測技術振興財団、稲盛財団、「物質・デバイス領域共同研究拠点」における「人・環境と物質をつなぐイノベーション創出ダイナミック・アライアンス」の研究助成の支援のもと遂行されました。
用語説明
注1.マイトファジー: 損傷したミトコンドリアを選択的に分解することでミトコンドリアの品質管理を行う細胞本来の自食作用(オートファジー)です。マイトファジーの一部の機構にはParkin(パーキン)が関与しています。Parkinはパーキンソン病の原因遺伝子とも言われています。
注2.フォトクロミック化合物: 光を吸収すると構造が異性化して、色調(吸収スペクトル)が変化する化合物のことで、サングラスなどの調光材料の原料として用いられている。アゾベンゼンは古くから有名なフォトクロミック化合物あり、光照射によってシス-トランス異性化反応を起こすことが知られています。
注3.光遺伝学: オプトジェネティクスとも呼ばれ、光応答性蛋白質を利用して細胞機能を操作する技術です。チャネルロドプシンを用いた光による神経細胞の活動制御が有名であり、最近では失明患者の治療への応用が試みられています。
注4.Chemically Induced Dimerization(CID)法: 標的蛋白質に蛋白質タグを融合発現させておき、二量化剤と呼ばれる低分子を添加することで蛋白質タグ間を選択的に連結する手法です。
論文情報
“Quantitative Control of Subcellular Protein Localization with a Photochromic Dimerizer”
Takato Mashita, Toshiyuki Kowada, Hayashi Yamamoto, Satoshi Hamaguchi, Toshizo Sato, Toshitaka Matsui, and Shin Mizukami*
Nature Chemical Biology
DOI:10.1038/s41589-024-01654-w
*責任著者:東北大学多元物質科学研究所 教授 水上 進



問い合わせ先
東北大学多元物質科学研究所
教授 水上 進(みずかみ しん)
TEL: 022-217-5116
Email: shin.mizukami*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学多元物質科学研究所 広報情報室
TEL: 022-217-5198
Email: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
日本医科大学先端医学研究所 事務室
TEL: 03-3822-2131
Email: sentankenjimushitsu.group*nms.ac.jp(*を@に置き換えてください)