発表のポイント
・ゴルジ体(注1)に亜鉛を取り込むヒト由来亜鉛トランスポーター(注2)ZnT7の立体構造をクライオ電子顕微鏡単粒子解析(注3)により、最高2.2 Å分解能という個々のアミノ酸がはっきりみえる分解能において、世界で初めて決定しました。
・ゴルジ体に亜鉛を放出する外向き型構造および細胞質から亜鉛を取り込む内向き型構造、さらには異なる複数の亜鉛結合状態の立体構造を決定し、亜鉛輸送の一連のスナップショットを捉えることに成功しました。
・ZnT7が膜貫通ヘリックス(注4)中の亜鉛結合部位に亜鉛を受け渡す分子機構を解明しました。
概要
亜鉛は全ての生物において必須の微量金属イオンであり、分子レベルではタンパク質の立体構造形成や酵素の触媒機能、細胞や個体のレベルでは、遺伝子発現の制御、正常な成長、生殖機能、健康維持において重要な役割を担っています。東北大学多元物質科学研究所のHan Ba Bui学術研究員、渡部聡助教、稲葉謙次教授らの研究グループは、これまで、ゴルジ体に局在して亜鉛を運ぶ分子である亜鉛トランスポーターZnT7やZnT5/6, ZnT4が、ゴルジ体における亜鉛濃度を厳密に制御していることを明らかとしてきました。しかし、これら亜鉛トランスポーターの立体構造は未決定であり、亜鉛輸送の詳細なメカニズムは未解明でした。
今回、同研究グループは、クライオ電子顕微鏡単粒子解析を用いて、亜鉛トランスポーターZnT7の立体構造を2.2Å分解能という高分解能で構造決定することに世界で初めて成功しました。
さらに、亜鉛を放出する直前および直後の立体構造を捉えることにも成功し、亜鉛輸送の一連のステップのほぼ全ての可視化に成功しました。亜鉛トランスポーターファミリーの一般的な分子機構の解明につながることが期待されるばかりか、細胞内の亜鉛恒常性維持機構に関する理解が格段に進みました。
本研究成果は、2023年8月8日に科学雑誌Nature Communicationsに掲載されました。
なお、本研究成果は東北大学大学院情報科学研究科の木下賢吾教授、医学系研究科の加藤幸成教授、京都大学大学院医学研究科の野村紀通准教授、岩田想教授、および東京大学大学院医学系研究科の吉川雅英教授らとの共同研究により得られたものです。
詳細な説明
研究の背景
亜鉛は、あらゆる生物において必須微量金属イオンとして存在しています。分子レベルでは、亜鉛は細胞内の様々なタンパク質と結合し、それらの立体構造形成を補助する役割を担うだけなく、酵素の活性中心において様々な化学反応を触媒する役割も有しています。また細胞内ではシグナル伝達因子としても機能しており、外部刺激に応答した遺伝子発現制御に関与しています。真核生物では、2種類の亜鉛トランスポーターが細胞内の亜鉛の恒常性維持に関わっています。ZIPファミリー亜鉛トランスポーターは、細胞外または細胞内小器官から亜鉛を細胞質へ取り込み、ZnTファミリー亜鉛トランスポーターは、細胞質から細胞外や細胞小器官への亜鉛輸送を行います。これら2種類の亜鉛トランスポーターが機能不全になると、細胞内外の亜鉛のバランスが崩れ、個体レベルでは、成長遅延、神経機能不全、糖尿病など様々な疾患を引き起こすことが知られています。
これまでに本研究チームは、細胞の分泌経路において、分子シャペロン(注5)として機能するERp44が、ゴルジ体内で亜鉛イオンと結合することで、そのシャペロン機能が促進されることを発見し、亜鉛イオンの新たな生理機能を明らかにしました(参考文献1)。さらに最近の本研究チームによる研究で、ゴルジ体の上流側に局在する亜鉛トランスポーターZnT7がERp44の機能制御に重要な役割を果たしていることを突き止めました(参考文献2)。
ZnT7は水素イオン(H+)と亜鉛を互いに逆向きに輸送するアンチポーター(注6)であり、ZnT7の遺伝性変異は、脂質代謝異常や、前立腺の腫瘍形成に関わっていることが知られています。これまでに同類の亜鉛トランスポーターとしては、細菌で機能するYiiPやインシュリン分泌顆粒で機能するZnT8の立体構造が報告されていました。しかし、これらのタンパク質とZnT7とはアミノ酸配列の相同性が低く、ZnT7の立体構造や亜鉛輸送のメカニズムはほとんど分かっていませんでした。また他の亜鉛トランポーターにおいて、亜鉛結合状態の一部しか構造が決定されておらず、亜鉛輸送機構の詳細なメカニズムは未解明でした。
今回の取り組み
本研究ではヒト由来ZnT7について、培養細胞を用いた高発現系を構築し、高純度の精製試料の調製を行い、クライオ電子顕微鏡単粒子解析によって高分解能構造決定に成功しました。まずZnT7単独での解析に取り組みましたが、電顕による構造解析を行うには分子サイズが十分ではなかったため、構造決定には至りませんでした。そこでZnT7の立体構造を特異的に認識する抗体をスクリーニングし、得られた抗体のFab分子とZnT7との複合体について、東北大学未来型医療創成センターに設置されているクライオ電子顕微鏡CryoARM300-II(JEOL製)と東京大学大学院医学系研究科に設置されているクライオ電子顕微鏡Titan Krios(Thermo Fisher製)を用いてデータ収集を行い、最終的に2.2Å分解能での構造決定に成功しました。
構造解析の結果、ZnT7は膜貫通ドメインとC末ドメインがそれぞれ強く相互作用した二量体を形成していることが分かりました(図1右)。二量体においては、膜貫通領域中の亜鉛結合部位がゴルジ体側に開いた(ゴルジ体に亜鉛を放出するのに適した)外向き型構造をとっていることが分かりました。さらに、取得した電顕データの詳細な解析から、一部の粒子は、上記の外向き型構造と、細胞質から亜鉛を取り込むためにゲートが開いた内向き型構造の両方を含む混合型の二量体構造をとることが分かりました(図1左)。
次にZnT7における亜鉛の結合様式を明らかにするため、亜鉛を含んだバッファー条件で精製試料を調整し、クライオ電顕単粒子解析を行いました(図2a)。その結果、ZnT7は外向き型/内向き型混合二量体構造をとっており、膜貫通領域中に高度に保存されたHDHDモチーフに亜鉛が結合していることが確認できました。興味深いことに、HDHDモチーフのうち、一つのHis240残基は、TMヘリックス5が曲がることで亜鉛から解離し、代わりにヒスチジンループ上のHis164が亜鉛輸送部位に入り込んで、亜鉛結合に関わっている様子が明らかになりました(図2b)。より高濃度に亜鉛を添加した条件でもZnT7の構造解析に取り組み、新たに2つの亜鉛結合型構造を決定しました(図2a,中央と右)。亜鉛結合構造2においては、ヒスチジンループ上のHis164は離れ、TM5がまっすぐに戻り、HDHDモチーフ中のHis240が亜鉛に配位していることが分かりました(図2c)。一方、外向き型構造において亜鉛が配位している様子を捉えることに成功し、その状態では、His70が亜鉛からやや離れた位置にあることが分かりました (図2d, e)。最終的にHis70が大きく離れることで亜鉛が放出されることが示されました(図2f)。以上の結果から、ZnT7nによる亜鉛輸送の詳細なスナップショットを明らかにすることができました(図3)。
今後の展開
本研究において、ヒト由来ZnT7による亜鉛輸送の詳細なメカニズムが明らかになりました。これの成果は、他の亜鉛トランポーターの輸送メカニズムの理解にもつながり、亜鉛トランススポーターをターゲットにした薬剤開発も加速することが期待できます。現時点で、ZnT7が二量体として機能する意義については十分に理解できていません。今後は、ZnT7に亜鉛を添加した後、異なる時間で試料を急速凍結およびグリッド作製を行い、クライオ電顕観察を行うことで、実際の亜鉛輸送過程に沿ったZnT7の構造解析に取り組む予定です。これにより、二量体中での連携した構造変化がより詳細に解明されると期待しています。
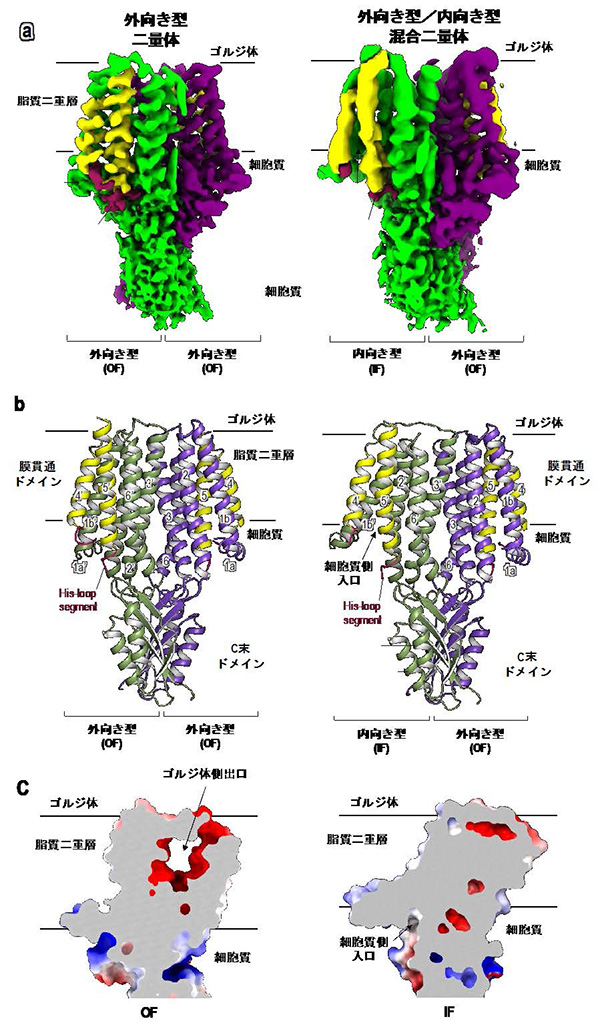
図1.ZnT7ニ量体のクライオ電子顕微鏡マップ(a)、分子構造モデル(b)、静電電荷マップの断面図(c)。
外向き型構造では、ゴルジ体側に亜鉛を放出する出口が形成される。一方、内向き型構造では、細胞質側から亜鉛を取り込むための入口が形成される。
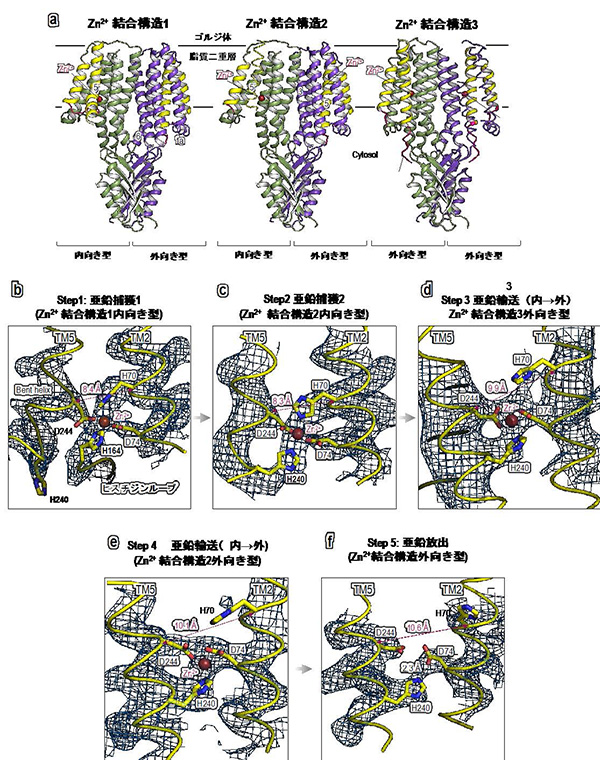
図2.3種類の亜鉛結合型ZnT7のクライオ電顕構造(a)と亜鉛結合部位の拡大図(b~f)。保存されたHDHDモチーフ(His70, Asp74, His240, Asp244)とHis164によって、亜鉛が配位されている。
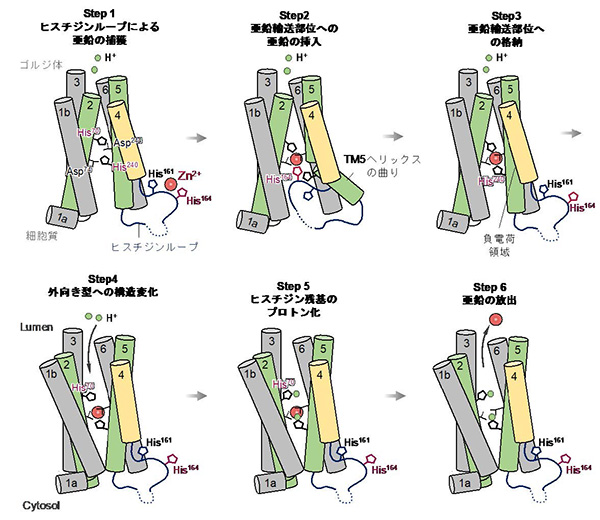
図3.ZnT7による亜鉛輸送機構のメカニズム。
謝辞
本成果は、以下の事業・研究課題の支援によって得られました。
■ 日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
・課題名:ケミカルプロテオスタシス:レドックス、pH、金属イオンが織りなすタンパク質品質管理機構の研究開発
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21gm1410006
■ 学術振興会科学研究費補助金基盤研究(A)
・課題名:初期分泌経路における亜鉛恒常性維持とタンパク質恒常性維持の相関と分子構造基盤
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21H04758
■ キヤノンメディカルシステムズ株式会社共同研究費
・課題名::SLCトランスポーターの網羅的機能解析
代表者:木下 賢吾(東北大学 大学院情報科学研究科 教授)
■ 日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
・課題名:クライオ電子顕微鏡による分子・細胞構造解析の支援と高度化
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP23ama121002
■ 日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)
・課題名:抗体関連高度開発支援と糖鎖細胞工学による高度化
代表者:加藤 幸成(東北大学 大学院医学系研究科 教授)
課題番号:JP19am0101078
■ 日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
・課題名:抗体を用いた膜タンパク質構造研究支援
代表者:岩田 想(京都大学 大学院医学研究科 教授)
課題番号:JP23ama121007
用語説明
注1.ゴルジ体
細胞内小器官の一つであり、シス、中間、トランスの層板構造を持つ。小胞体からゴルジ体に輸送されてきた分泌タンパク質は、糖鎖修飾や部位特異的切断、金属イオンの配位などを受ける。最近の研究から、ゴルジ体では遊離亜鉛濃度が20~100 nMと他の細胞内小器官に比べて高い濃度で保たれていることが判明した。
注2.亜鉛トランスポーター
生体膜を隔てて亜鉛イオンの輸送を行う膜内在性のタンパク質。細胞外やオルガネラ内腔から細胞質方向へ亜鉛イオンを輸送するZIPファミリー、その反対方向へ輸送するZnTファミリーの2種類が知られる。
注3.クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築することができる。
注4.膜貫通ヘリックス
生体膜中に存在する多くの膜タンパク質は、膜貫通領域にαヘリックスと呼ばれるらせん状の規則正しい構造を複数含んでいる。特に膜を介して物質を輸送する膜トランスポーターは、膜貫通ヘリックスの中に物質を取り込み、膜貫通へリックスの配向を巧みに変化させ、物質を効率よく放出すると考えられている。
注5.分子シャペロン
タンパク質の折りたたみを促すタンパク質の総称。新規に翻訳合成され天然型立体構造を獲得していないタンパク質は、凝集しやすく細胞毒性を示すが、シャペロンタンパク質が結合することで凝集が抑制され、天然型構造へのフォールディングが促進される。
注6.アンチポーター
細胞膜中で2種類以上の分子またはイオンを反対方向に輸送する膜輸送体の総称。
論文情報
Han Ba Bui, Satoshi Watanabe, Norimichi Nomura, Kehong Liu, Tomoko Uemura, Michio Inoue, Akihisa Tsutsumi, Hiroyuki Fujita, Kengo Kinoshita, Yukinari Kato, So Iwata, Masahide Kikkawa, *Kenji Inaba
“Cryo-EM structures of human zinc transporter ZnT7 reveal the mechanism of Zn2+ uptake into the Golgi apparatus”
*責任著者:東北大学多元物質科学研究所 教授 稲葉 謙次(大学院生命科学研究科/理学研究科化学専攻 兼担、九州大学生体防御医学研究所クロスアポイント)
Nature Communications
DOI:10.1038/s41467-023-40521-5
(参考文献1)2019年2月に公表した成果については下記をご参照ください。
Satoshi Watanabe, Yuta Amagai, Sara Sannino, Tiziana Tempio, Tiziana Anelli, Manami Harayama, Shoji Masui, Ilaria Sorrentino, Momo Yamada, Roberto Sitia, and Kenji Inaba, “Zinc regulates ERp44-dependent protein quality control in the early secretory Pathway” Nature communications, 10, 603. (2019)
DOI: 10.1038/s41467-019-08429-1
プレスリリース:「細胞内の亜鉛の新しい生理的役割が明らかに 亜鉛とシャペロンタンパク質 ERp44 による新しいタンパク質品質管理機構の仕組みを解明」(2019年2月13日)
(参考文献2)2023年5月に公表した成果については下記をご参照ください。
Yuta Amagai, Momo Yamada, Toshiyuki Kowada, Tomomi Watanabe, Yuyin Du, Rong Liu, Satoshi Naramoto, Satoshi Watanabe, Junko Kyozuka, Tiziana Anelli, Tiziana Tempio, Roberto Sitia, Shin Mizukami, *Kenji Inaba. “Zinc homeostasis governed by Golgi-resident ZnT family members regulates ERp44-mediated proteostasis at the ER-Golgi interface” Nature communications
DOI: 10.1038/s41467-023-38397-6
プレスリリース:「ゴルジ体の亜鉛調節機構を解明:ゴルジ体亜鉛トランスポーターの機能不全による病気発症機構の解明に期待」(2023年5月18日)
関連リンク:
東北大学
九州大学
京都大学
東京大学
東北大学大学院医学系研究科・医学部
東北大学大学院情報科学研究科
東北大学大学院理学研究科・理学部
東北大学大学院生命科学研究科
国立研究開発法人 日本医療研究開発機構 AMED
生体分子構造研究分野(稲葉謙次研究室)
問い合わせ先
東北大学 多元物質科学研究所
教授 稲葉 謙次(いなば けんじ)
(大学院生命科学研究科/理学研究科化学専攻 兼担、
九州大学生体防御医学研究所クロスアポイント)
Tel: 022-217-5604
E-mail: kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
九州大学 広報課
Tel: 092-802-2130
E-mail: koho*jimu.kyushu-u.ac.jp(*を@に置き換えてください)
京都大学 渉外部広報課国際広報室
Tel: 075-753-5729
E-mail: comms*mail2.adm.kyoto-u.ac.jp(*を@に置き換えてください)
東京大学大学院医学系研究科・医学部
総務チーム(総務担当)
Tel:03-5841-3304
E-mail: ishomu*m.u-tokyo.ac.jp(*を@に置き換えてください)