国立大学法人東北大学
国立大学法人九州大学
国立大学法人東京大学大学院理学系研究科
大学共同利用機関法人高エネルギー加速器研究機構
発表のポイント
・血液凝固因子などの分泌に必須であるヒト由来カーゴ受容体ERGIC-53とその補助因子MCFD2との複合体の立体構造をクライオ電子顕微鏡単粒子解析(注1)により世界で初めて決定しました。
・全長ERGIC-53は、従来提唱されていた六量体ではなく、四葉のクローバーに類似した四量体構造を取り、曲がったり伸びたりする柔軟な構造変化を通して、カーゴを輸送する仕組みが分かりました。
・ERGIC-53-MCFD2複合体のヘッド領域の高分解能構造解析から、MCFD2に亜鉛結合部位があることが初めて明らかになり、カーゴ輸送における亜鉛を介した新たな制御機構が明らかになりました。
概要
血液凝固因子などの分泌タンパク質は、細胞内の小胞体(注2)において合成された後、積荷(カーゴ)として特異的なカーゴ受容体によって認識され、効率よく細胞外へと分泌されています。カーゴ輸送の異常は、血液性疾患などの様々な遺伝性疾患の原因となることが知られています。カーゴ輸送の中心を担うカーゴ受容体として、ERGIC-53とその補助因子MCFD2が約40年前に同定され、ERGIC-53の糖鎖を認識する領域(ドメイン)を中心に構造機能研究が進められてきました。しかしその全長構造は未決定で、全長において多様なカーゴを認識し輸送する仕組みは未解明のままでした。
東北大学多元物質科学研究所の渡部聡助教、稲葉謙次教授らの研究グループは、クライオ電子顕微鏡単粒子解析を用いて、全長ERGIC-53と補助因子MCFD2との複合体の立体構造を世界で初めて決定しました。構造解析の結果、全長構造はヘッド領域、ストーク領域、膜貫通領域で構成されており、四葉のクローバーに類似した全体構造をとることが分かりました。また、ERGIC-53の全長構造のダイナミックな構造変化の様子の可視化にも成功し、柔軟な構造変化を利用したカーゴ認識機構が明らかになりました。また、ERGIC-53-MCFD2複合体のヘッド領域を高分解能で構造決定し、四量体形成の詳細な分子基盤が明らかになっただけではなく、MCFD2において新たに亜鉛結合部位があることが分かり、分泌経路下流におけるカーゴの解離が亜鉛によって促進される機構が示唆されました。
本研究成果は、2024年3月16日に科学雑誌Nature Communicationsに掲載されました。
本研究成果は東京大学大学院理学系研究科の木瀬孔明特任准教授、濡木理教授、および高エネルギー加速器研究機構(KEK) 物質構造科学研究所の米澤健人研究員(現:奈良先端科学技術大学院大学)、清水伸隆教授らとの共同研究により得られたものです。
詳細な説明
研究の背景
血液凝固因子などの分泌タンパク質は、細胞内小器官である小胞体において合成後、積荷(カーゴ)として特異的なカーゴ受容体によって認識され、効率よく細胞外へと分泌されています。カーゴ受容体の一つであるERGIC-53は、補助因子MCFD2と協同して機能しており、血液凝固第V因子、第VIII因子や、アンチトリプシンなどの分泌タンパク質を小胞体で捕獲し下流のゴルジ体(注3)に輸送する役割を担っています。ERGIC-53やMCFD2の遺伝性変異は、先天性血管疾患の原因であることが知られています。この他にERGIC-53は、細胞表層膜タンパク質やコロナウイルスなどRNAウイルスの表面糖タンパク質の細胞内輸送にも関与していることが報告されています。
ERGIC-53は、積荷の糖鎖を認識するドメイン(CRD)、ストークドメイン、膜貫通ヘリックスで構成されています。C末端のKKFFモチーフ(注4)は、小胞体とゴルジ体間のサイクルに必要と考えられています。これまでにERGIC-53のCRDについては、立体構造が結晶構造解析によって決定され、糖鎖の認識機構の一部が明らかになっていました。しかしながら、全長ERGIC-53の立体構造は未解明であり、どのように様々な積荷タンパク質をERGIC-53が認識し輸送するかについては、全く分かっていませんでした。
今回の取り組み
本研究ではヒト由来全長ERGIC-53について、培養細胞を用いた高発現系を構築し、試行錯誤の上、高純度の精製試料の精製方法を確立しました。ERGIC-53は、約40年前に同定されて以来、六量体として機能していると考えられてきました。しかし、当時の実験的根拠が不十分だったため、最新の解析技術を用いてERGIC-53の会合状態の再解析に取り組みました。まずERGIC-53の会合状態を、溶液中の絶対分子量を測定することができるSEC-MALS法(注5)によって解析した結果、ERGIC-53は六量体ではなく四量体として存在していることが分かりました。さらに全長ERGIC-53溶液構造をKEKの放射光実験施設フォトンファクトリーのビームラインBL-15A2を利用したSEC-SAXS(注6)によって解析したところ、ERGIC-53は分子長が非常に長くダンベル型の構造をとっていることが示唆されました。
次に、東京大学大学院医学系研究科に設置されているクライオ電子顕微鏡Titan Krios(Thermo Fisher製)と東北大学未来型医療創成センターに設置されているクライオ電子顕微鏡CRYO-ARM300-II(JEOL製)を利用して、ERGIC-53 とMCFD2との複合体のクライオ電子顕微鏡単粒子解析に取り組みました。撮影した電顕画像から長く伸びたダンベル状の粒子が観察されました。このユニークな形ゆえに、汎用的な自動粒子拾い上げプログラムでは、全長ERGIC-53粒子を認識することはできませんでした。代わりに、ダンベル両端の重りにあたる球状部分を独立な粒子として拾い上げることによって各領域のみの構造解析に取り組み、最終的にヘッド領域構造を2.5Å分解能で決定しました(図1)。構造解析の結果、ストークドメイン中の長いαヘリックスが、中央で4本集まってコイルドコイル(注7)構造を形成することで、四量体を形成していることが明らかになりました。また4つのCRDは、それぞれMCFD2と1:1に相互作用しており、並行に配置しているのではなく、2つずつ上下に重なることで、ヘッド構造を安定に形成していることが分かりました。
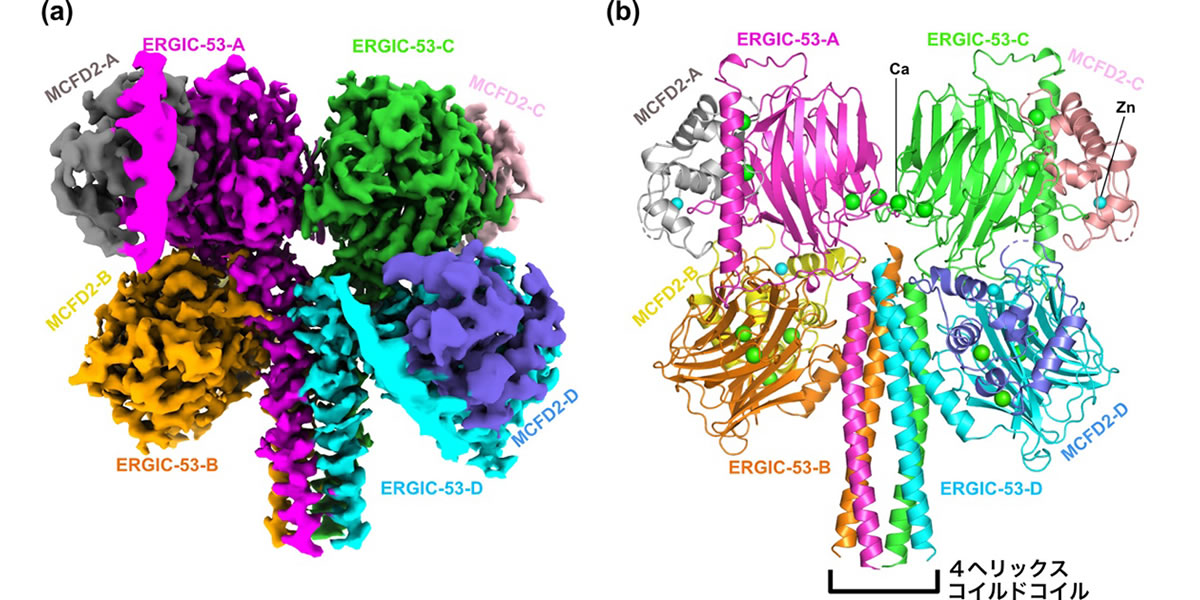
図1. ERGIC-53-MCFD2複合体のヘッド領域の高分解能構造
(a)クライオ電子顕微鏡によって得られた密度マップ。(b)構築したヘッド領域の分子構造モデル。ERGIC-53のストークドメイン内の長いαヘリックスが4本集まり、4ヘリックス-コイルドコイルを形成することで、ERGIC-53が四量体を形成している。
さらに、電顕画像から全長ERGIC-53粒子を手動で拾い上げ、画像認識分野で活用されている畳み込みニューラルネットワーク(注8)を利用した自動粒子拾い上げプログラム(Topaz)に学習させることで、全長として自動粒子拾い上げに成功し、全長ERGIC-53-MCFD2複合体の構造解析にも成功しました。構造解析の結果、全長の複合体の全体構造は、四葉のクローバーに類似しており、4つのCRDを中心として構成されたヘッド領域、3組の4ヘリックス-コイルドコイルで構成された細長いストーク領域、およびTM領域で構成されていることが明らかになりました(図2a,b)。SAXSの結果から予想されたように、全長の分子長は340Åであり、現在報告されている膜タンパク質の立体構造としては、もっとも“背が高い”構造であることが分かりました。また取得した電顕マップから、動的な動きを解析する手法(三次元変動解析)を用いることで、ストーク領域が、コイルドコイル間のループ領域を曲折点として柔軟に動いている様子や、ヘッド領域が回転する動きなどを可視化することに成功しました(図2c)。実際に、測定した全長ERGIC-53粒子の二次元平均像では、ストーク領域がさらに90度近く曲がった像も観察されており(図2a)、ストーク領域が大きく動いていることが示されました。このような結果から、ストーク領域やヘッド領域の可動性を利用し、ERGIC-53がカーゴ結合部位であるヘッド領域の高さを調節することで、ターゲットの積荷分子を認識していることが示唆されました。
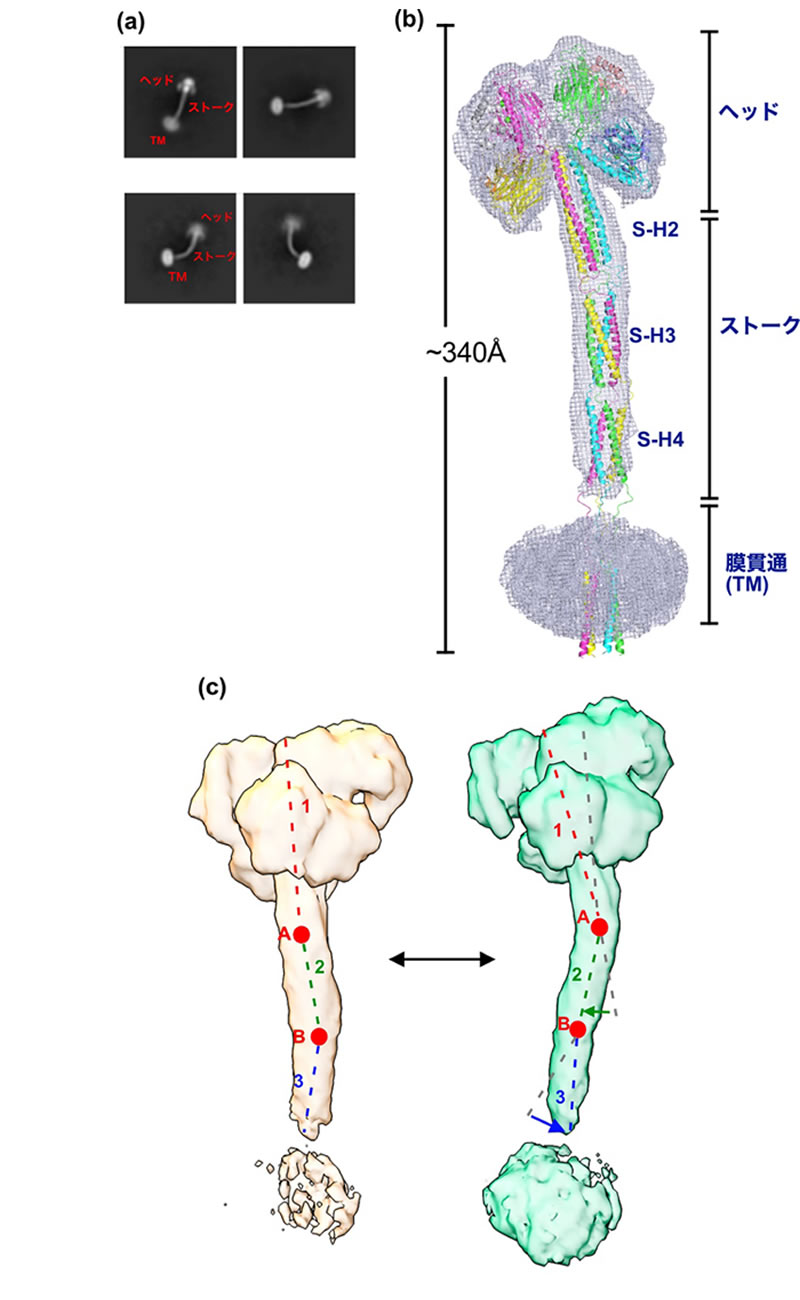
図2. 全長ERGIC-53-MCFD2複合体のクライオ電子顕微鏡構造
(a)全長ERGIC-53粒子の二次元平均像。真っ直ぐな形のものや大きく曲がった形の構造が見られた。(b) クライオ電顕で得られた全長の密度マップと構築した全長モデル。ストーク領域は、3組の4ヘリックス-コイルドコイルで形成されている。(c) 三次元変動解析によるERGIC-53の動的な構造変化。コイルドコイル間のループ領域(AとB)を曲折点として動く様子が観察された。
一方、ヘッド領域の高分解能構造解析から、補助因子MCFD2において、4つの保存されたヒスチジン残基が集まり、亜鉛結合部位を形成していることが明らかになりました(図3a)。以前に報告されたMCFD2の結晶構造では、N末領域の構造は電子密度が確認できませんでしたが、今回決定した亜鉛結合型では、N末領域がαヘリックスを形成していました。興味深いことに、このN末領域のαヘリックスは、MCFD2内の積荷結合部位を覆っており、亜鉛結合型のMCFD2では積荷の結合が妨げられる、別の言い方をすれば亜鉛結合によって積荷の解離が促進されることが示唆されました。最近、本研究グループは、ゴルジ体では亜鉛トランポーターによって亜鉛が取り込まれ、遊離亜鉛濃度が高く保たれていることを明らかにしています(参考文献1,2)。ERGIC-53は、小胞体において積荷を捕獲して、ゴルジ体で積荷を解離すると考えられていますが、本研究結果によって、ゴルジ体において、亜鉛がMCFD2に結合することで、ERGIC-53から積荷の解離が促進されるという、亜鉛の新たな生理機能が明らかになりました(図3b)。
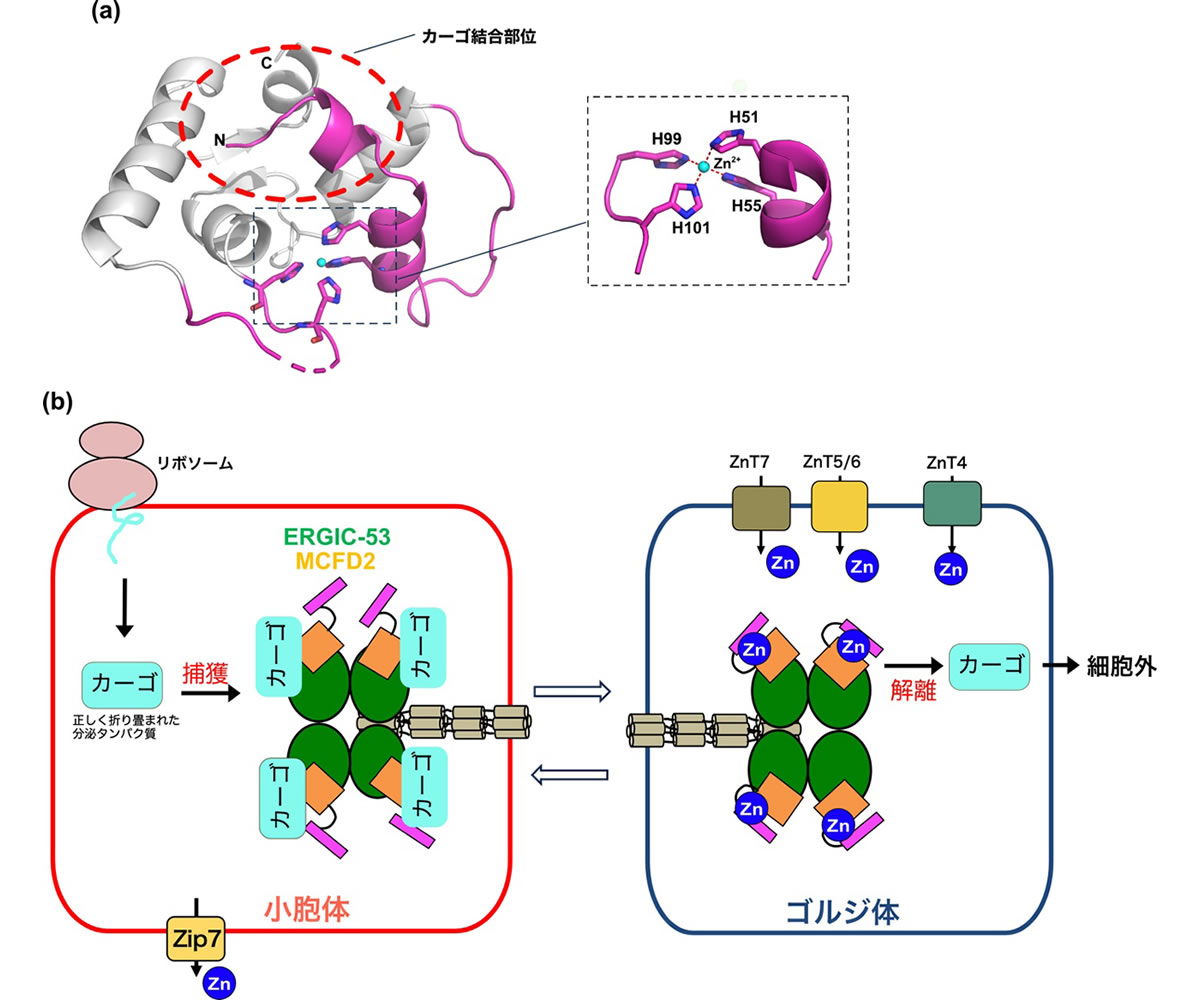
図3. 亜鉛によるカーゴ輸送の制御機構
(a) クライオ電子顕微鏡で決定したMCFD2の分子構造。今回の構造解析で立体構造が分かった領域をマジェンタで示した。構造解析の結果、4つのヒスチジン残基が集まり、亜鉛結合部位が形成されることが分かった(拡大図)。この亜鉛結合型では、MCFD2のカーゴ結合部位(赤点線領域)がN末αヘリックスで覆われており、亜鉛結合によってN末αヘリックスがカーゴ結合部位を遮蔽し、カーゴ解離を促進することが示唆された。 (b) 本研究で提唱する亜鉛によるカーゴ輸送の制御機構。小胞体において合成された分泌タンパク質は、カーゴとしてERGIC-53に捕獲され、効率よくゴルジ体に運ばれる。ゴルジ体では、亜鉛濃度が高く保たれており、亜鉛が結合することでERGIC-53からカーゴが解離し、細胞外へ分泌される。
今後の展開
本研究において、ヒト由来ERGIC-53の柔軟な全長構造を高分解能で初めて明らかにし、分泌タンパク質の輸送機構の一端が明らかになりました。今後は、血液凝固因子やウイルスタンパク質などとERGIC-53との複合体のクライオ電顕単粒子解析や、種々の顕微鏡による輸送小胞に取り込まれる過程のリアルタイム観察に取り組むことで、積荷認識から輸送までの詳細な分子機構の解明を目指す予定です。また本研究によって、亜鉛イオンの新たな生理機能が明らかになり、亜鉛不足や過剰亜鉛と様々な疾病との因果関係がさらに解明されることが期待されます。
謝辞
本成果は、以下の事業・研究課題の支援によって得られました。
学術振興会科学研究費補助金基盤研究(C)
課題名:免疫グロブリンMの成熟化に関与するシャペロン複合体の分子機構の解明
代表者:渡部 聡(東北大学 多元物質科学研究所 助教)
課題番号:JP18K06075
学術振興会科学研究費補助金 挑戦的研究(萌芽)
課題名:クライオ電子顕微鏡による「柔らかい」一回膜貫通タンパク質の可視化
代表者:渡部 聡(東北大学 多元物質科学研究所 助教)
課題番号:JP23K18193
内藤記念科学奨励金・研究助成(2018年度)
課題名:pHと金属イオンを利用した新たなタンパク質品質管理機構の分子基盤の解明
代表者:渡部 聡(東北大学 多元物質科学研究所 助教)
令和3年度持田記念医学薬学振興財団 研究助成金(2021年度)
血液凝固因子等の分泌糖タンパク質の選択的細胞内輸送機構の構造基盤の解明と創薬への応用
代表者:渡部 聡(東北大学 多元物質科学研究所 助教)
学術振興会科学研究費補助金 学術変革領域研究A
課題名: クロススケール細胞内分子構造動態解析が解明する小胞体恒常性維持機構
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
分担者:渡部 聡(東北大学 多元物質科学研究所 助教)
課題番号:JP21H05253
日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
課題名:ケミカルプロテオスタシス:レドックス、pH、金属イオンが織りなすタンパク質品質管理機構の研究開発
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21gm1410006
日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)
課題名:シナプスタンパク質の品質管理と神経変性疾患における破綻機構の解明
代表者:木瀬孔明(東京大学理学研究科 特任准教授)
課題番号:JP22gm6410026
(構造解析支援)
日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
課題名:クライオ電子顕微鏡による分子・細胞構造解析の支援と高度化
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP21am0101115
日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
課題名:創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(PFにおけるタンパク質立体構造解析の支援と高度化、相関構造解析への展開
代表者:千田 俊哉(高エネルギー加速器研究機構 教授)
課題番号:JP21am0101071
日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
課題名:高難度膜タンパク質等の調製と構造解析可能なグリッド調製の支援
代表者:濡木 理(東京大学 大学院理学系研究科 教授)
課題番号:JP23ama121012
日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
課題名:オープンイノベーションを基軸としたアカデミア創薬の推進
代表者:山本 雅之(東北大学 東北メディカル・メガバンク機構 教授)
課題番号:JP21am0101095
日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)
課題名:ゲノム・オミックス・タンパク質構造情報を活用したアカデミア発の創薬支援
代表者:山本 雅之(東北大学 東北メディカル・メガバンク機構 教授)
課題番号:JP23ama121038
用語説明
注1. クライオ電子顕微鏡単粒子解析: タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、各粒子の三次元配向を計算し、統合することで高分解能の三次元構造(平均構造)を構築することができる。さらに平均構造を基準として、三次元の変動性を解析することにより、構築した電顕構造の動的な構造変化を捉える方法も開発されている。
注2. 小胞体: 細胞内小器官の一つであり、分泌タンパク質の合成が行われる。小胞体の中には厳正なタンパク質品質管理機構が備わっており、正しい立体構造を形成したタンパク質は下流のゴルジ体へ選択的に輸送される。
注3. ゴルジ体: 細胞内小器官の一つであり、小胞体からゴルジ体に輸送されてきた分泌タンパク質の糖鎖修飾、部位特異的切断、金属イオンの配位などを行う。ゴルジ体で加工を受けた分泌タンパク質は、トランスゴルジネットワークを介して細胞外や細胞内オルガネラなどの目的区画へと輸送される。
注4. KKFFモチーフ: C末端のフェニルアラニン残基が2つ並んだアミノ酸配列(FF)は、小胞体からゴルジ体への移行に必要なモチーフである。一方2つのリジン残基が並んだアミノ酸配列(KK)は、ゴルジ体から小胞体への逆行輸送に必要である。この2つのモチーフを持つことでERGIC-53は、小胞体とゴルジ体との間をサイクルできる。
注5. SEC-MALS: タンパク質を分子サイズで分画するゲル濾過クロマトグラフィー(SEC)と多角度光散乱法(MALS)を組み合わせることにより、溶液中のタンパク質の絶対分子量やサイズ形状の分散性を測定することができる。
注6. SEC-SAXS: タンパク質を分子サイズで分画するゲル濾過クロマトグラフィー(SEC)と溶液のX線散乱を測定する小角散乱法(SAXS)を組み合わせる方法で、溶液中のタンパク質の分子長やフォールディング状態などの溶液構造情報を取得することができる。
注7. コイルドコイル: タンパク質会合様式の一つ。αヘリックスが、2~7本、互いに絡み合って会合し、さらに安定な構造体(コイル)を形成して、タンパク質複合体形成を安定化させる働きがある。転写因子やモータータンパク質、コラーゲンなど、様々なタンパク質複合体で見られる。
注8. 畳み込みニューラルネットワーク: 畳み込みニューラルネットワークは、人の脳における神経細胞(ニューロン)間の信号伝達の仕組みを模倣した数理モデルの一つで、主に画像認識の分野で活用されている。識別したい画像の局所的な特徴量を抽出するフィルター(畳みこみ層)を利用することで、効率の高い学習や高精度の画像判別が可能となっている。
参考文献
1.2023年5月に公表した成果については下記をご参照ください。
タイトル:Zinc homeostasis governed by Golgi-resident ZnT family members regulates ERp44-mediated proteostasis at the ER-Golgi interface
著者: Yuta Amagai, Momo Yamada, Toshiyuki Kowada, Tomomi Watanabe, Yuyin Du, Rong Liu, Satoshi Naramoto, Satoshi Watanabe, Junko Kyozuka, Tiziana Anelli, Tiziana Tempio, Roberto Sitia, Shin Mizukami, *Kenji Inaba.
雑誌名:Nature Communications
DOI:10.1038/s41467-023-38397-6
URL:https://www.nature.com/articles/s41467-023-38397-6
プレスリリース「ゴルジ体の亜鉛調節機構を解明 ゴルジ体亜鉛トランスポーターの機能不全による病気発症メカニズムの解明に期待」(2023年5月18日)
URL:https://www.tohoku.ac.jp/japanese/2023/05/press20230518-02-golgi.html
2.2023年8月に公表した成果については下記をご参照ください。
タイトル:Cryo-EM structures of human zinc transporter ZnT7 reveal the mechanism of Zn2+ uptake into the Golgi apparatus
著者:Han Ba Bui, Satoshi Watanabe, Norimichi Nomura, Kehong Liu, Tomoko Uemura, Michio Inoue, Akihisa Tsutsumi, Hiroyuki Fujita, Kengo Kinoshita, Yukinari Kato, So Iwata, Masahide Kikkawa, *Kenji Inaba
雑誌名:Nature Communications
DOI:10.1038/s41467-023-40521-5
URL:https://www.nature.com/articles/s41467-023-40521-5
プレスリリース「クライオ電子顕微鏡により、ゴルジ体の亜鉛輸送体による亜鉛輸送機構の全容を解明 細胞の亜鉛恒常性維持機構の理解に大きな進展」
URL:https://www.tohoku.ac.jp/japanese/2023/08/press20230828-02-cryo.html
論文情報
“Structure of full-length ERGIC-53 in complex with MCFD2 for cargo transport”
Satoshi Watanabe*, Yoshiaki Kise, Kento Yonezawa, Mariko Inoue, Nobutaka Shimizu, Osamu Nureki and Kenji Inaba*
Nature Communications
DOI:10.1038/s41467-024-46747-1
*責任著者:
東北大学多元物質科学研究所(生命科学研究科、理学研究科化学専攻 兼担)助教 渡部 聡
東北大学多元物質科学研究所(生命科学研究科、理学研究科化学専攻 兼担、九州大学生体防御医学研究所クロスアポイント)教授 稲葉 謙次
▶ 東北大学
▶ 九州大学
▶ 東京大学大学院理学系研究科
▶ 高エネルギー加速器研究機構(KEK)
▶ 東北大学 大学院 生命科学研究科
▶ 東北大学 大学院理学研究科・理学部
問い合わせ先
東北大学 多元物質科学研究所
助教 渡部 聡(わたなべ さとし)
(生命科学研究科/理学研究科化学専攻 兼担)
Tel:022-217-5605
Email:satoshi.watanabe.c1*tohoku.ac.jp(*を@に置き換えてください)
東北大学 多元物質科学研究所
教授 稲葉 謙次(いなば けんじ)
(生命科学研究科/理学研究科化学専攻 兼担、
九州大学生体防御医学研究所クロスアポイント)
Tel:022-217-5604
Email:kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所広報情報室
Tel:022-217-5198
Email:press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
九州大学 広報課
Tel:092-802-2130
Email:koho*jimu.kyushu-u.ac.jp(*を@に置き換えてください)
東京大学大学院理学系研究科・理学部 広報室
Tel:03-5841-8856
Email:media.s*gs.mail.u-tokyo.ac.jp(*を@に置き換えてください)
高エネルギー加速器研究機構
Tel:029-879-6047
Email:press[at]kek.jp