発表のポイント
- 化合物に応答して二重鎖DNAの形成と解離を自在に制御できる新規人工核酸を開発しました。
- この人工核酸を用いて、in vitro(注1)で遺伝子発現を可逆的に制御することに成功しました。
- 遺伝子発現を基盤とする合成生物学研究やバイオテクノロジーの開発に貢献できるほか、高精度な遺伝子治療への応用が期待されます。
【概要】
DNAに保存された遺伝情報をもとにRNA(注2)を経てタンパク質が生成される過程は遺伝子発現と呼ばれ、最も基本的な生命現象です。近年、遺伝子を人工的に設計・合成することが可能となり、人工遺伝子を用いた基礎研究やバイオテクノロジーの開発が大きな潮流を生み出しています。これら人工遺伝子を用いる研究においては、その発現を精密に制御する技術が必要不可欠です。しかし、これまでに報告されている制御法は、効率や生体適用性が不十分であり、新たな手法の開発が必要と考えられていました。
東北大学多元物質科学研究所(東北大学大学院理学研究科化学専攻 兼担)の岡村秀紀 助教、永次史 教授、大学院生の矢尾健行 氏(大学院理学研究科化学専攻)は、特定の化合物の添加に応答して、遺伝子発現を可逆的に制御可能な人工核酸の開発に成功しました。これらの人工核酸は、ホスト—ゲスト相互作用(注3)による可逆的な結合を通じて二重鎖の解離と形成を制御することにより、転写過程のOFF—ONを精密に切り替えます。本研究で用いたホスト—ゲスト相互作用は、生体条件下でも機能します。そのため、本人工核酸を用いることで、生体深部における遺伝子発現制御を実現できる可能性があり、遺伝子発現を基盤とするバイオテクノロジーや治療法の高精度化につながることが期待されます。本研究成果は、科学誌Journal of the American Chemical Societyのオンライン版に2024年6月28日に掲載されました。
【詳細な説明】
研究の背景
DNAは、A-T, G-C塩基対(注4)の形成を介して二重鎖DNAを形成し、A, G, C, Tの並び方によって遺伝情報を保存します。この遺伝情報をもとにRNAが転写され、タンパク質へと翻訳されます。これらの一連の過程は遺伝子発現と呼ばれ、最も根源的な生命現象と捉えることができます。2000年代はじめにゲノムプロジェクトが完了し、遺伝子発現に関する理解が大きく進展しました。また、DNAの合成技術も進歩し、ゲノムスケールのDNAを合成できるようになりました。その結果、人工的に設計した遺伝子を用いて、遺伝子発現過程の理解や応用を試みる研究が大きな潮流を生み出しています。
これら人工遺伝子を用いる研究において、遺伝子発現をオンデマンドにスイッチングできる技術は、強力なツールとなります。例えば、特定のタンパク質の産生を任意のタイミングでOFF—ON制御できれば、高精度な遺伝子治療の開発につながる可能性があります。このような遺伝子発現の制御には従来、時空間制御性に優れた光応答性の人工分子やタンパク質などが利用されてきました。しかし、光は生体分子に損傷を与えてしまう可能性があるほか、透過性に本質的な課題があり、応用範囲が限定的です。
このような背景のもと、本研究では、生体適合性のある低分子化合物に応答して遺伝子発現を可逆制御できる新規技術の開発を目指しました。遺伝子発現の最初のステップである転写過程では、RNAポリメラーゼ(注5)がプロモーターと呼ばれる二重鎖DNA領域を特異的に認識し、RNAが合成されます。つまり、このプロモーター配列の二重鎖形成を低分子化合物によって可逆制御できれば、遺伝子発現のオンデマンドなスイッチングが可能となると考えられます。そこでまず、二重鎖形成を可逆制御できる新規人工核酸の開発を計画しました。
今回の取り組み
本研究では、ホスト—ゲスト相互作用という特定の化学構造同士の可逆的な結合を利用して、二重鎖の解離と形成を制御できる人工核酸「ゲスト修飾アデノシン」を設計しました(図1)。この人工核酸には、ホスト分子であるククルビット[7]ウリル(CB[7])と結合するゲスト構造を導入しています。ゲスト修飾アデノシンはチミジンと安定な塩基対を形成し、二重鎖を形成します。ここにCB[7]を添加すると、かさ高いホスト—ゲスト複合体を形成し、その立体障害により二重鎖が解離されます。さらに、より強く結合する別のゲスト分子(=交換用ゲスト分子)の添加により、ゲスト修飾アデノシンとCB[7]の複合体が解離し二重鎖の再形成が可能であると考えました。具体的にはCB[7]と非常に強く結合するアダマンタンをゲスト構造としても持つゲスト修飾アデノシン(Am2dA)を組み込んだDNAを化学合成し、二重鎖DNAの熱的安定性をUV 融解温度(Tm)測定によって評価しました。その結果、Am2dAを組み込んだDNAは狙い通り、安定な二重鎖を形成すること、CB[7]の添加によって二重鎖が一本鎖にほどけること、さらに交換用ゲスト分子の添加によって二重鎖が再形成することを確認しました。また、ゲスト構造をノルアダマンタンもしくはビシクロ[2.2.2]オクタンに変えたNaddAとBicdAを組み込んだDNAでは、交換用ゲストの添加に伴う二重鎖の再形成を加速できることも見出しました。
続いて、これらの人工核酸を用いて、無細胞遺伝子発現系における遺伝子発現制御を試みました(図2)。まず、転写に用いられるT7 RNAポリメラーゼが結合するT7プロモーター領域に、NaddAを組み込んだDHFR遺伝子を化学酵素的手法(注6)により合成しました。このNaddA修飾DHFR遺伝子と無細胞遺伝子発現系であるPUREfrex を用いて、DHFR蛋白質の発現を調べたところ、CB[7]添加時にはDHFRタンパク質はほとんど発現しませんでした。ここに交換用ゲスト分子を添加すると、CB[7]添加前と同様にDHFRタンパク質が得られることがわかりました。また、NaddAの代わりにAm2dA修飾DHFR遺伝子を用いた場合には、CB[7]添加時による蛋白質発現阻害はNaddAと同様に観測されましたが、ゲスト交換速度がゆっくりであるために、交換用ゲスト分子の添加による遺伝子発現の回復も緩やかになることもわかりました。以上の結果から、本研究で開発した人工核酸を用いたシステムにより、遺伝子発現の可逆的制御が可能になったと考えています。また、用いる人工核酸の種類によって、遺伝子発現量や速度をチューニングできることから、その応用性も高いと考えられます。
今後の展望
本研究で開発した人工核酸は、遺伝子発現を可逆的かつ時間的に制御できるため、無細胞転写翻訳系を用いた人工細胞の創成やバイオテクノロジー研究を加速すると期待されます。CB[7]によるホスト—ゲスト相互作用は、生体条件下でも進行することが報告されており、今回のシステムは核酸医薬や治療用遺伝子を任意のタイミングで安全に機能させる仕組みとしても展開できると期待されます。また、ゲスト修飾アデノシンは、二重鎖形成を可逆制御できることから、DNAを機能性材料としたナノ構造体形成の可逆制御にも応用可能です。このように今回開発した人工核酸を用いたシステムは様々な領域への応用が可能であることから、今後の展開が期待されます。
【謝辞】
本研究は、公益財団法人上原記念生命科学財団と科学研究費補助金(JP 23K04957)などの支援を受けて遂行されました。研究グループは「機器測定でご助力いただいた東北大学大学院理学研究科の西澤精一教授、佐藤雄介准教授、Chioma Uche Okeke博士に、この場を借りて御礼申し上げます」と述べています。
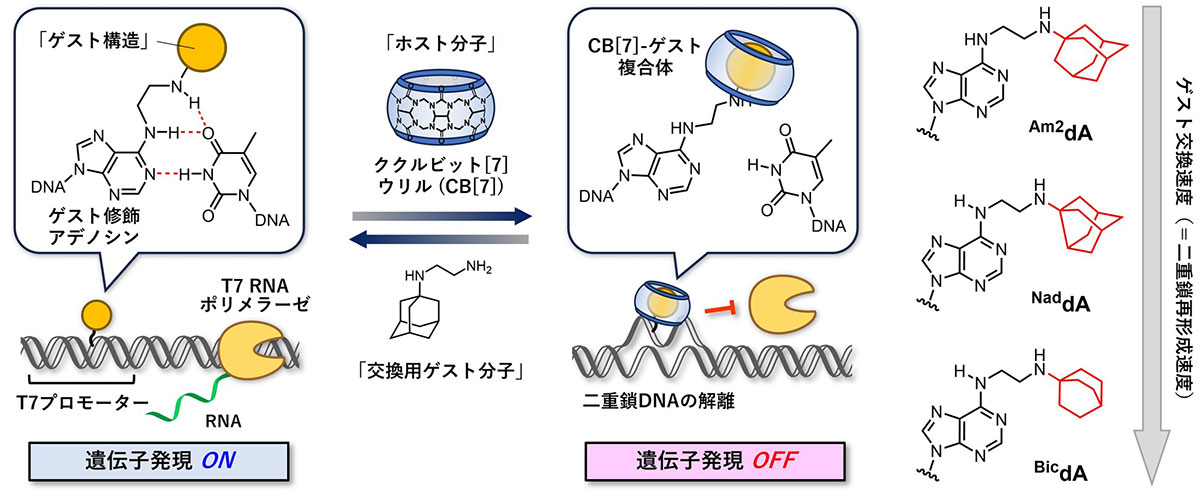
図1. ホスト-ゲスト相互作用によって二重鎖DNAを解離・再形成できるゲスト修飾アデノシンの設計と遺伝子発現の可逆制御への応用。

図2. 無細胞転写翻訳系における遺伝子発現の可逆制御。
用語説明
注1.in vitro:「試験管内で」という意味。生化学実験等において、試験管内で生体内に準ずる環境を人工的に作り、実験を行うことを示す。
注2.RNA:リボ核酸の略。タンパク質をコードするメッセンジャーRNAのほか、コードしないノンコーディングRNAも存在し、その種類ごとに様々な機能を持つ。
注3.ホスト—ゲスト相互作用: ホスト(受容体)分子とゲスト(リガンド)分子の間で起こる特異的な相互作用のこと。ホスト分子とゲスト分子は、静電相互作用やファンデルワールス相互作用といった非共有結合によって結合するため、可逆的な結合性を示す。
注4.A-T, G-C塩基対:DNA中のアデニン(A)とチミン(T)、グアニン(G)とシトシン(C)が、それぞれ相補的な水素結合によって結びついた対のこと。これらの塩基対形成は、二重らせん構造の形成と遺伝情報の複製・伝達において重要な役割を果たす。
注5.RNAポリメラーゼ:DNAを鋳型にしてRNAを転写する酵素。DNA中のプロモーター配列に結合したのち、リボヌクレオチドを相補的に取り込むことで、RNAを合成する。
注6.化学酵素的手法:化学酵素的手法:化学反応と酵素反応を組み合わせて、特定の化合物を合成する手法。本研究では、化学合成した人工核酸を、DNA合成酵素(DNAポリメラーゼ)によって伸長した。
論文情報
“Reversible control of gene expression by guest-modified adenosines in a cell-free system via host–guest interaction”
Hidenori Okamura*, Takeyuki Yao, Fumi Nagatsugi*
Journal of the American Chemical Society
*責任著者:東北大学多元物質科学研究所(理学研究科化学専攻 兼担)助教 岡村 秀紀、 教授 永次 史
DOI:10.1021/jacs.4c04262
問い合わせ先
東北大学多元物質科学研究所
助教 岡村 秀紀(おかむら ひでのり)
(理学研究科化学専攻 兼担)
電話:022-217-5634
Email:hidenori.okamura.b8*tohoku.ac.jp(*を@に置き換えて下さい)
東北大学多元物質科学研究所
教授 永次 史(ながつぎ ふみ)
(理学研究科化学専攻 兼担)
電話:022-217-5633
Email:fumi.nagatsugi.b8*tohoku.ac.jp(*を@に置き換えて下さい)
(報道に関すること)
東北大学多元物質科学研究所 広報情報室
電話:022-217-5198
Email:press.tagen*grp.tohoku.ac.jp(*を@に置き換えて下さい)
