発表のポイント
・ゴルジ体内での遊離亜鉛濃度の分布を高空間分解能で明らかにしました。
・ゴルジ体に局在する3つの亜鉛トランスポーター複合体ZnT4、ZnT5/6、ZnT7に依存したゴルジ体内の厳密な亜鉛濃度制御機構を解明しました。
・亜鉛結合型シャペロンタンパク質ERp44の機能と細胞内輸送に、3つのZnT複合体が異なる役割を果たすことを発見しました。
概要
亜鉛は必須微量元素であり、全ての生物の成長、健康維持に重要な役割を持ちます。一方、消化酵素やホルモンなど多くの分泌タンパク質は小胞体で合成され、ゴルジ体(注1)を経由して成熟化します。
これまで研究チームは、ゴルジ体でシャペロンタンパク質(注2)ERp44が亜鉛イオンと結合することで分泌タンパク質の品質管理(注3)を行うことを発見しました(参考文献参照)。またいくつかの分泌タンパク質は、ゴルジ体を経由する過程で亜鉛と結合し、成熟することも報告されています。このようにゴルジ体による亜鉛イオン濃度の制御は生理的に非常に重要であることは判明しているものの、その制御機構についてはほとんど未解明でした。
東北大学多元物質科学研究所の天貝佑太助教、渡部聡助教、稲葉謙次教授、小和田俊行助教、水上進教授、大学院生命科学研究科の経塚淳子教授、およびサン・ラファエル研究所(イタリア)のロベルト シティア教授らは、ゴルジ体の亜鉛イオン濃度調節の詳細な分子機構の一端を解明し、そのタンパク質品質管理機構における役割を明らかにしました。研究チームは亜鉛定量プローブZnDA-1Hを用いた濃度計測により、ゴルジ体内に約60~100nMの亜鉛濃度の勾配が存在することを発見しました。また超解像顕微鏡(注4)を用いた観察により、3つの亜鉛トランスポーター(注5)複合体がゴルジ体の異なる層板に局在し、亜鉛濃度、ひいてはERp44の細胞内局在、輸送、機能を調節することを解明しました。
本成果はゴルジ体の亜鉛恒常性維持の破綻が分泌タンパク質の生合成異常、ひいては病態発生のメカニズム解明につながることが期待されます。本研究成果は、2023年5月9日に科学雑誌Nature Communicationsに掲載されました。
詳細な説明
研究の背景
ヒトの体で働くタンパク質の約10%は亜鉛と結合し、亜鉛イオンはこれらのタンパク質の立体構造形成を促進する役割や、タンパク質酵素の活性中心に配位し、種々の化学反応を触媒する役割を持ちます。そのため、亜鉛の調節機構が失われると、成長遅延、神経機能不全、糖尿病など様々な病態につながります。
例えば、癌細胞浸潤に関わるマトリクスメタロプロテアーゼや、骨形成疾患に関わるアルカリホスファターゼなどを含む分泌型亜鉛酵素はゴルジ体の亜鉛トランスポーターに依存してゴルジ体中で亜鉛イオンを獲得し活性化します。また、分泌経路内の亜鉛調節機構の破綻はコラーゲン層の形成を阻害することが知られています。
亜鉛は細胞膜に存在するZIPファミリー亜鉛トランスポーターによって細胞内へと取り込まれた後、ZnTファミリー亜鉛トランスポーターによって、細胞中の様々なオルガネラへと輸送され調節されています。
新規に合成された分泌タンパク質は小胞体・ゴルジ体を経由して成熟化しますが、その過程でタンパク質の品質は厳密に管理されています。ERp44というシャペロンタンパク質は、高次構造が未成熟な抗体やアディポネクチンなどを基質タンパク質としてゴルジ体で捕獲し小胞体へと送り返すことで、これらタンパク質の成熟化を促進します。
これまでに研究チームは、ゴルジ体内に輸送された亜鉛イオンがERp44と結合することでそのシャペロン機能が亢進することを発見し、亜鉛イオンのタンパク質の品質管理における新たな生理機能を提唱してきました。しかしながら、ERp44がどのようにゴルジ体で亜鉛イオンを獲得するのか、またゴルジ体内でどのように亜鉛イオン濃度が制御されているのかはほとんど不明でした。
今回の取り組み
ゴルジ体内の亜鉛濃度を詳細に解析するために、指定したオルガネラに局在可能な蛍光性亜鉛プローブZnDA-1Hを用いました。ZnDA-1HはHaloタグリガンドを持つ化合物で、人工的に発現させたHaloタグタンパク質が局在する特定のオルガネラの亜鉛定量イメージングが可能です。ゴルジ体は複数の層板が重なった構造をしており、小胞体に近い側から、それぞれシス、中間、トランスゴルジ体と呼ばれます。それぞれの層板に加え、シスゴルジ体よりも上流領域に局在する領域(プレシスゴルジ体)における亜鉛濃度を測定したところ、プレシスゴルジ体では100 nM、それ以外のゴルジ体では60~80 nM程度の遊離亜鉛が存在することが明らかとなりました (図1)。続いて、ゴルジ体にはZnT4、ZnT5/6、ZnT7が局在し、ゴルジ体内へ亜鉛イオンを輸送することが知られていたことから、それぞれの遺伝子の発現をノックダウン法によって抑制した細胞でゴルジ体の亜鉛濃度を測定したところ、ZnT4、ZnT5/6、ZnT7はそれぞれゴルジ体のトランス側、中間、シス側の亜鉛濃度維持に重要であることを見出しました。超解像顕微鏡を用いた観察から、ZnT7はプレシスゴルジ体、ZnT6はシスから中間ゴルジ体に局在することが明らかとなり、亜鉛濃度制御の結果と合致していました (図2)。
ZnT発現抑制細胞におけるERp44局在、細胞内輸送、機能について解析したところ、ERp44は主にプレシスゴルジ体でZnT7依存的に亜鉛を獲得することが分かりました。一方で、ZnT5/6およびZnT4によって中間、トランスゴルジ体に取り込まれた亜鉛は、プレシスゴルジ体で亜鉛を獲得できなかったERp44のゲートキーパーとして働くことが明らかとなりました (図3)。
以上の知見は、ゴルジ体に存在する複数の亜鉛トランスポーター(ZnT4, 5/6, 7)の異なる機能と相補的役割を初めて解明したものであり、細胞がこれら亜鉛トランスポーターを利用することで、小胞体・ゴルジ体のタンパク質品質管理を厳密に制御していることが明らかとなりました。
今後の展開
今回、ゴルジ体内の亜鉛濃度分布を高空間分解能で測定し、ZnTファミリーによる調節機構を解明しました。小胞体・ゴルジ体には、オルガネラ内腔から細胞質へ亜鉛イオンを輸送するZIPファミリーメンバーも複数存在します。本解析手法を適用することによって、ZIPファミリーとZnTファミリーが協調して小胞体・ゴルジ体亜鉛濃度を維持する機構が解明されることが期待されます。これまで、ZnT5は心疾患に、ZnT7は糖尿病に、ZIP7はB細胞成熟化にそれぞれ関わることが報告されてきました。亜鉛輸送体による亜鉛恒常性維持機構の研究が発展することで、これら疾病の発症メカニズムを理解する上で重要な知見になると考えられます。
また今回用いた計測解析手法は、ゴルジ体に限らず、核やミトコンドリアなどの他のオルガネラにおける遊離亜鉛の定量にも応用可能です。本研究手法の適用によって、細胞中での亜鉛制御機構の詳細が解明され、将来的には亜鉛制御不全が疾病の原因となるメカニズムが解明されることが期待されます。
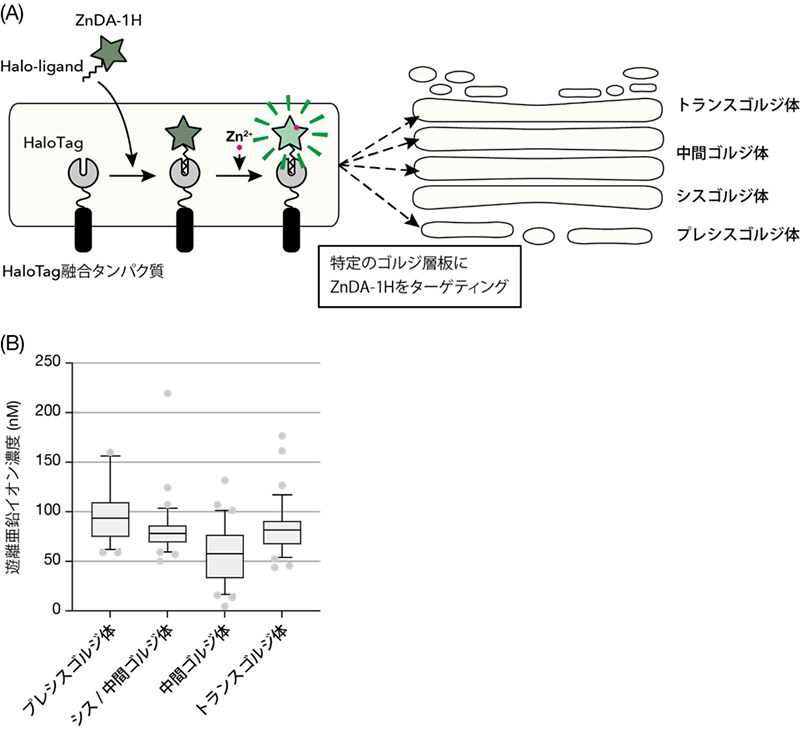
図1. ゴルジ体遊離亜鉛イオン濃度測定 (A) ゴルジ体の各層板に局在する様々なHaloTag融合タンパク質を作製し、ZnDA-1Hをそのゴルジ層板に特異的に局在させ、生細胞亜鉛イメージングを行った。(B)各ゴルジ層板における遊離亜鉛イオン濃度の定量値。

図2. ノコダゾール処理をして得られるゴルジミニスタックを超解像顕微鏡を用いて観察し、ZnT6とZnT7のゴルジ体内局在を詳細に解析した。ZnT6(緑)はシスゴルジ体(青)から中間ゴルジ体(赤)にかけて局在する一方で、ZnT7はシスゴルジ体よりも上流領域に局在している。スケールバーは500 nmを指す。
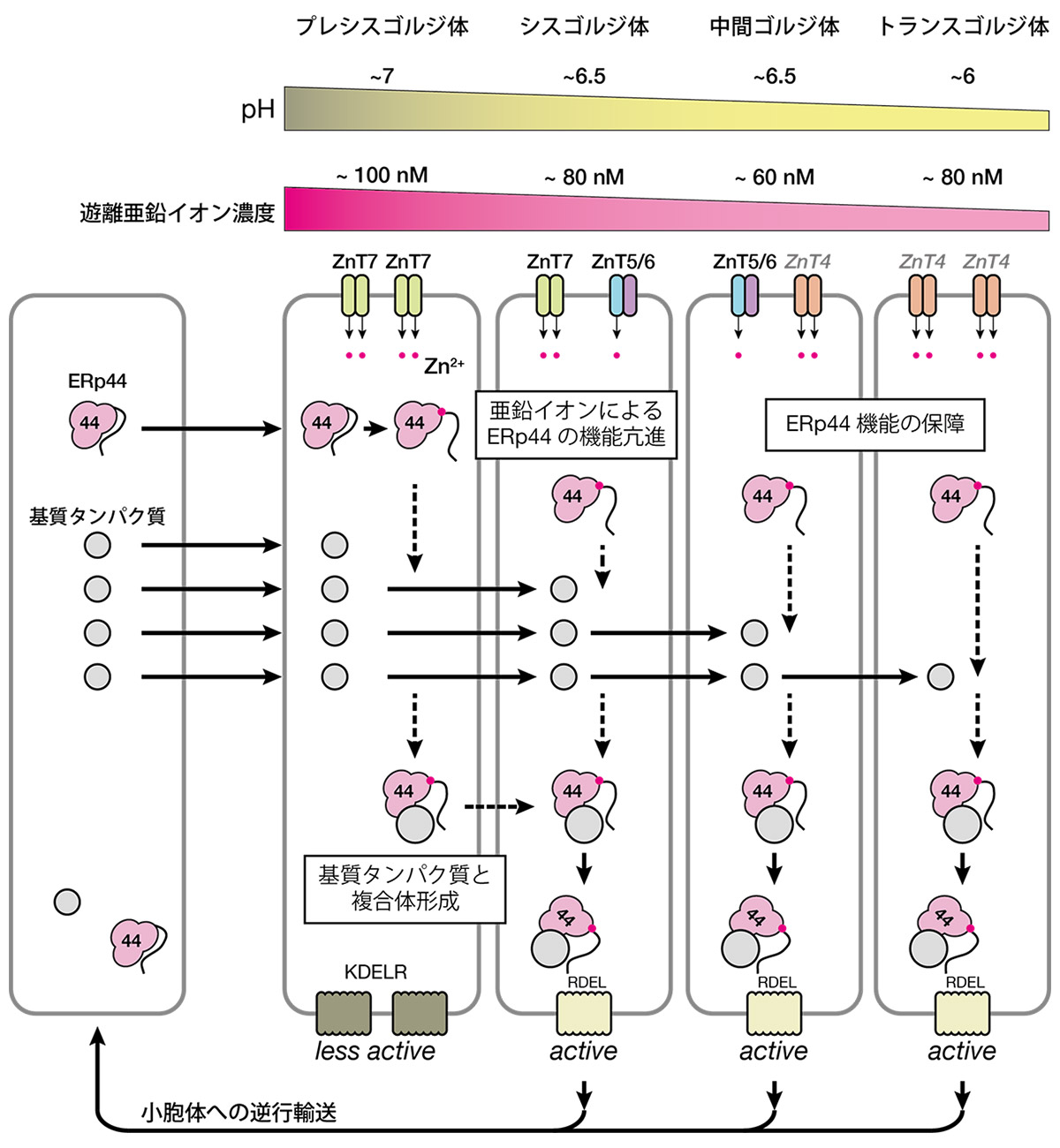
図3. ゴルジ体局在型ZnTによるERp44機能制御機構。ERp44はプレシスゴルジ体領域で亜鉛イオンを獲得することで、基質タンパク質との複合体形成が促進される。基質タンパク質と複合体を形成したERp44はシスゴルジ体以降の領域から小胞体へ逆行輸送されると示唆された。中間/トランスゴルジ体における亜鉛濃度維持はERp44の機能を保障するために重要であることが明らかとなった。
謝辞
本成果は、以下の事業・研究課題の支援によって得られました。
■ 日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
・課題名:ケミカルプロテオスタシス:レドックス、pH、金属イオンが織りなすタンパク質品質管理機構の研究開発
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
分担者:水上 進(東北大学多元物質科学研究所 教授)
課題番号:JP21gm1410006
■ 学術振興会科学研究費補助金基盤研究(A)
・課題名:亜鉛イオンとERp44の連携による分泌経路の新たなタンパク質品質管理機構
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP18H03978
■ 学術振興会科学研究費補助金基盤研究(A)
・課題名:初期分泌経路における亜鉛恒常性維持とタンパク質恒常性維持の相関と分子構造基盤
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21H04758
■ 学術振興会科学研究費基金若手研究
・課題名:亜鉛輸送体とERp44による初期分泌経路タンパク質品質管理機構の解明
代表者:天貝 佑太(東北大学 多元物質科学研究所 助教)
課題番号:JP19K16065
■ 学術振興会科学研究費補助金新学術領域研究「生命金属科学」
・課題名:初期分泌経路への亜鉛流入機構と亜鉛酵素活性化機構の解明
代表者:天貝 佑太(東北大学 多元物質科学研究所 助教)
課題番号:JP20H05494
■ 公益財団法人旭硝子財団
・課題名:細胞生物学とケミカルバイオロジーの融合による初期分泌経路の亜鉛イオン動態の解明
代表者:天貝 佑太(東北大学 多元物質科学研究所 助教)
■ 学術振興会科学研究費基金基盤研究(C)
・課題名:環状リガンドの配座制御を基盤としたタンパク質局在の光制御法の開発
代表者:小和田 俊行(東北大学 多元物質科学研究所 助教)
課題番号:JP20K05702
用語説明
注1.ゴルジ体
細胞内小器官の一つであり、シス、中間、トランスの層板構造を持つ。小胞体からゴルジ体に輸送されてきた分泌タンパク質は、糖鎖修飾や部位特異的切断、金属イオンの配位などを受ける。ゴルジ体で加工を受けた分泌タンパク質は、トランスゴルジネットワークを介して細胞外や細胞内オルガネラなどの目的区画へと輸送される。
注2.シャペロンタンパク質
タンパク質の折りたたみを促すタンパク質の総称。新規に翻訳合成され天然型立体構造を獲得していないタンパク質は、凝集しやすく細胞毒性を示すが、シャペロンタンパク質が結合することで凝集が抑制され、天然型構造へのフォールディングが促進される。
注3.分泌タンパク質の品質管理
分泌タンパク質の多くは、翻訳合成される過程で小胞体中に挿入される。挿入直後は天然型の立体構造を保持していないため、小胞体中の様々なシャペロンタンパク質がその折りたたみを補助する。最終的に天然型の立体構造を獲得した分泌タンパク質分子は目的の区画へと輸送されるが、天然型立体構造を獲得できなかったタンパク質は分解される。
注4.超解像顕微鏡
通常の光学顕微鏡ではxy方向の空間分解能が230 nm程であり、それを光の回折限界と呼ぶが、その空間分解能を超えた解像度で観察が可能な顕微鏡。本研究ではCarl ZEISS社のAiryscan2超解像顕微鏡を使用した。
注5.亜鉛トランスポーター
生体膜を隔てて亜鉛イオンの輸送を行う膜内在性のタンパク質。細胞外やオルガネラ内腔から細胞質方向へ亜鉛イオンを輸送するZIPファミリー、その反対方向へ輸送するZnTファミリーの2種類が知られる。
論文情報
Yuta Amagai, Momo Yamada, Toshiyuki Kowada, Tomomi Watanabe, Yuyin Du, Rong Liu, Satoshi Naramoto, Satoshi Watanabe, Junko Kyozuka, Tiziana Anelli, Tiziana Tempio, Roberto Sitia, Shin Mizukami, *Kenji Inaba.
“Zinc homeostasis governed by Golgi-resident ZnT family members regulates ERp44-mediated proteostasis at the ER-Golgi interface”
*責任著者:東北大学多元物質科学研究所 教授 稲葉 謙次(大学院生命科学研究科/理学研究科化学専攻 兼担、九州大学生体防御医学研究所クロスアポイント)
Nature Communications
DOI:10.1038/s41467-023-38397-6
URL:https://www.nature.com/articles/s41467-023-38397-6
(参考文献)2019年2月に公表した成果については下記をご参照ください。
Satoshi Watanabe, Yuta Amagai, Sara Sannino, Tiziana Tempio, Tiziana Anelli, Manami Harayama, Shoji Masui, Ilaria Sorrentino, Momo Yamada, Roberto Sitia, and Kenji Inaba, “Zinc regulates ERp44-dependent protein quality control in the early secretory Pathway” Nature communications, 10, 603. (2019)
DOI: 10.1038/s41467-019-08429-1
プレスリリース:「細胞内の亜鉛の新しい生理的役割が明らかに 亜鉛とシャペロンタンパク質 ERp44 による新しいタンパク質品質管理機構の仕組みを解明」(2019年2月13日)
関連リンク:
九州大学
東北大学
東北大学大学院理学研究科・理学部
東北大学大学院生命科学研究科
国立研究開発法人 日本医療研究開発機構 AMED
生体分子構造研究分野(稲葉謙次研究室)
問い合わせ先
東北大学 多元物質科学研究所
教授 稲葉 謙次(いなば けんじ)
(大学院生命科学研究科/理学研究科化学専攻 兼担、
九州大学生体防御医学研究所クロスアポイント)
Tel: 022-217-5604
E-mail: kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)
九州大学 広報課
Tel: 092-802-2130
E-mail: koho*jimu.kyushu-u.ac.jp(*を@に置き換えてください)