JST戦略的創造研究推進事業において、東北大学の稲葉謙次教授、熊本大学の小椋光教授、京都産業大学の永田和宏教授らのグループは、X線結晶構造解析により、ジスルフィド結合開裂酵素ERdj5のクラスターの配向が異なる2つの結晶構造を解明しました。
細胞内には、正常なたんぱく質の高次構造形成反応を促進する仕組みがある一方で、構造異常のたんぱく質を速やかに分解・除去するための巧妙な品質管理システムも存在します。Protein Disufide Iso merase (PDI) ファミリーたんぱく質の1つであるERdj5は、哺乳動物細胞の小胞体中で誤って形成されたジスルフィド結合を還元し、小胞体関連分解と呼ばれる分解機構を促進させる役割を担っています。ERdj5の全体構造はそれぞれが複数のドメインから構成されている2つのクラスター(N末端側クラスターとC末端側クラスター)に分けることができます。両クラスターは、フレキシブルなリンカー領域で連結されていることから、動きに富むことが示唆されていました。しかし、この動きがERdj5の機能発現にどう関わるか不明だったため、詳細な分子機構の解明が求められていました。
さらに高速原子間力顕微鏡により、ERdj5のC末端側クラスターがダイナミックに動いている様子を一分子レベルで観察することに世界で初めて成功しました。さらに細胞を用いた実験により、ERdj5のC末端側クラスターの動きが、構造異常たんぱく質中のジスルフィド結合の還元および分解促進に重要な役割をもつことが強く示唆されました。
本研究の成果は、2017年5月4日(米国東部時間)に「Structure」のオンライン速報版で公開されました。
プレスリリース本文 (PDF)
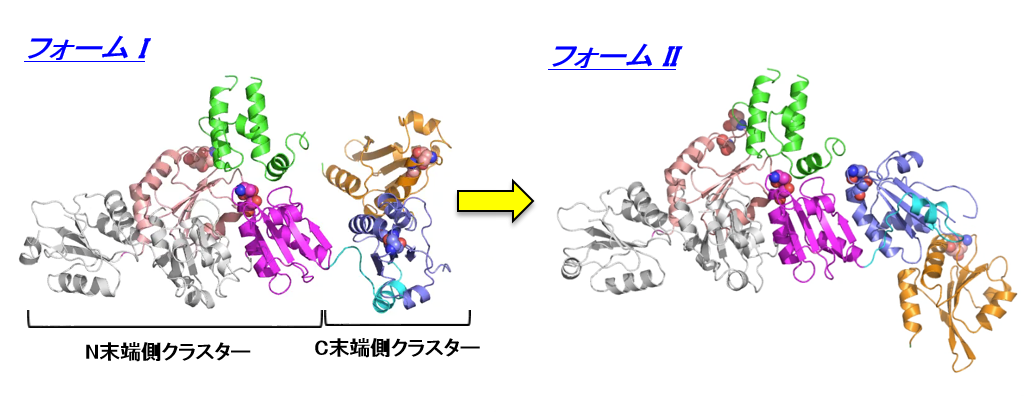
ERdj5の2つのコンフォメーション:2011年に本研究グループが報告したオリジナルな構造(フォームI:左図)に比べ、新しい構造(フォームII:右図)はC末端側クラスターが約110度回転し、クラスターの配向が大きく異なる。
論文情報:
“The highly dynamic nature of ERdj5 is key to efficient elimination of aberrant protein oligomers through ER-associated degradation”
ERdj5の高い動的性質は小胞体関連分解を介した異常タンパク質オリゴマーの効率的な分解に重要である
Ken-ichi Maegawa, Satoshi Watanabe, Kentaro Noi, Masaki Okumura, Yuta Amagai, Michio Inoue, Ryo Ushioda, Kazuhiro Nagata, Teru Ogura, and Kenji Inaba
Structure, USA
doi: 10.1016/j.str.2017.04.001
関連リンク:
稲葉研究室(生体分子構造研究分野)
理学研究科・理学部ウェブサイト
生命科学研究科ウェブサイト
JSTウェブサイト
京都産業大学ウェブサイト
東北大学ウェブサイト
問い合わせ先
東北大学 多元物質科学研究所 教授
稲葉 謙次(イナバ ケンジ)
Tel:022-217-5604
E-mail:kinaba*tagen.tohoku.ac.jp(*を@に置き換えてください)
<報道に関すること>
東北大学 多元物質科学研究所 広報情報室
伊藤 智恵(イトウ トモエ)
Tel:022-217-5866
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)