発表のポイント
・クライオ電子顕微鏡構造解析により、細胞中のカルシウムの恒常性維持に重要な小胞体膜局在カルシウムポンプSERCA2bの反応中間状態の構造を決定した。
・カルシウムポンプを駆動するためのエネルギー供給源であるATP分子をSERCA2bが取り込む新しい機構を解明した。
概要
細胞小器官の一つである小胞体は、カルシウムを取り込むことで細胞内カルシウムイオン濃度を適切に維持しています。SERCA2bは筋収縮の制御、神経伝達、アポトーシスの誘導、タンパク質の品質管理など、様々な生命現象において重要な役割をもつ細胞内カルシウムイオンの恒常性を保つ上で必須の小胞体膜局在カルシウムポンプですが、一部の反応中間状態の構造しか決定されていませんでした。
東北大学多元物質科学研究所の張 玉霞助教、渡部 聡助教、門倉 広准教授、稲葉 謙次教授(生命科学研究科、理学研究科化学専攻 兼担)、および東京大学大学院医学系研究科の包 明久助教、吉川 雅英教授らを中心とした共同研究グループは、SERCA2bの高分解能構造を、クライオ電子顕微鏡単粒子解析注1という技術を用いて決定しました。その結果、カルシウムポンプを駆動するのに必要なエネルギーの供給源であるATP注2分子をSERCA2bが取り込むための新たな機構を発見しました。
本研究成果は、2021年8月30日に欧州生命科学誌 The EMBO Journalに掲載されました。
▸ プレスリリース本文(PDF)
研究の背景
小胞体は膜タンパク質や分泌タンパク質の生合成やカルシウムの貯蔵を行う細胞内小器官です。小胞体膜局在のATP駆動型カルシウムポンプであるSERCA2bは、細胞質から小胞体内へカルシウムを取り込むことで、カルシウムの制御や細胞内のカルシウム濃度の恒常性維持において重要な役割をもつことが知られています。SERCA2bは、筋肉組織特異的に発現するアイソフォーム注3のSERCA1aやSERCA2aとは異なり、全組織に発現しています。
SERCA2bのアイソフォームであるSERCA1aについては、過去に様々な中間状態で構造が決定されていますが、SERCA2bについては、まだ一部の反応中間状態の構造しか決定されておりませんでした。そこで、SERCA2bのカルシウムポンプ機構を原子レベルで理解するため、カルシウム結合およびATP非結合状態(すなわちATPが結合する前の状態)のSERCA2bについて、クライオ電子顕微鏡による構造解析を試みました。
研究の内容と成果
本研究ではまず、カルシウム結合およびATP非結合状態のSERCA2bを調製するため、カルシウム存在下およびATP非存在下でSERCA2bを精製しました。その試料を用いて電子顕微鏡測定のためのグリッドを作製し、東京大学大学院医学系研究科に設置されているハイエンドクライオ電子顕微鏡装置Titan Krios (ThemoFisher製)を用いて、データ収集を行いました。その結果、カルシウム結合およびATP非結合状態のSERCA2bについて、3.3 Å分解能で構造決定することに成功しました。その結果、Aドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、膜貫通ヘリックスドメインからなるSERCA2bの全体構造が明らかとなりました(図1)。
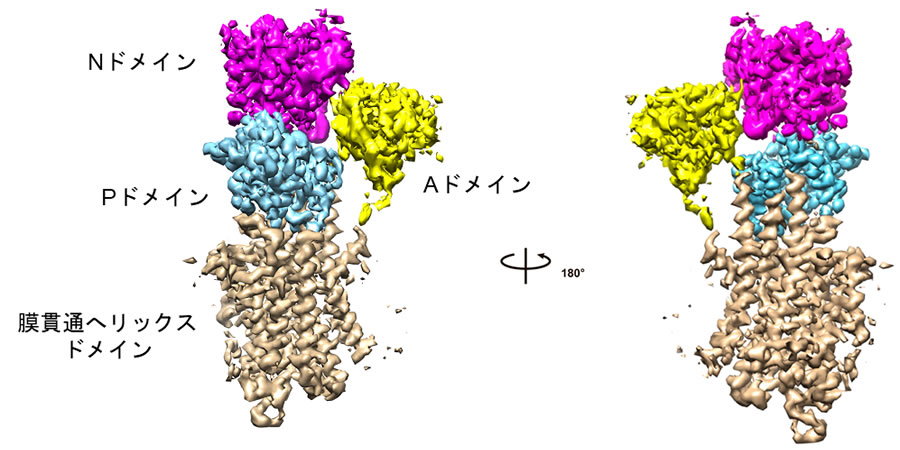
図1. 本研究により明らかとなったヒト由来小胞体カルシウムポンプSERCA2bのクライオ電子顕微鏡構造
SERCA2bはAドメイン(駆動ドメイン:黄色)、 Nドメイン(ATP結合ドメイン:ピンク)、 Pドメイン(リン酸化ドメイン:水色)の三つのサイトゾル側ドメインと膜貫通ヘリックスドメイン(ベージュ)からなる。本研究では、カルシウムイオン結合およびATP非結合状態のSERCA2bのクライオ電子顕微鏡構造を解くことに成功し、この状態では三つのサイトゾル側ドメインがコンパクトに閉じたクラスターを形成していることが明らかとなった。
過去のSERCA1aのX線結晶構造解析注4の結果から、SERCAのカルシウムポンプを駆動するのに必要なエネルギー源であるATPは、細胞質側のドメインが大きく開いた状態で取り込まれると考えられてきました(図2右)。しかしながら今回、クライオ電子顕微鏡による構造解析を行ったところ、多くの分子は、細胞質側のドメインが閉じたコンパクトな構造をとっていることが分かりました(図2左)。
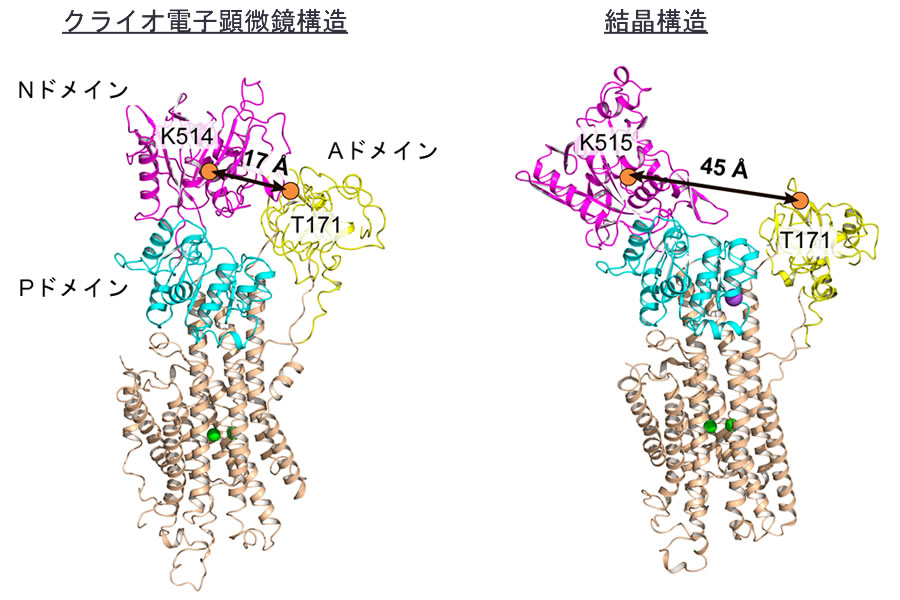
図2. 本研究により決定されたATP結合前のSERCA2bのクライオ電子顕微鏡構造(左)と過去に報告された同じ反応中間状態のSERCA1aの結晶構造(右)
これら二つの構造の比較により、本研究により解かれたクライオ電子顕微鏡構造では、過去に報告された結晶構造と比べ、三つのサイトゾル側ドメインが閉じ、コンパクトなクラスターを形成していることが分かる。具体的には、Aドメインに位置する171番目のスレオニン残基とNドメインに位置する514番目のリシン残基(SERCA1aでは515番目)の距離が、クライオ電子顕微鏡構造では17Åであるのに対し、結晶構造では45Åである。我々の生化学実験により、クライオ電子顕微鏡構造で示されたコンパクトな構造の状態でも、ATPは正しくSERCA2bに結合することが示された。
この閉じた状態でATP分子がSERCA2bの正しい位置に結合するかを調べるため、細胞質側のドメインの相対配置を固定する分子間ジスルフィド結合をSERCA2bに導入し、この変異体のATP結合能と加水分解活性を調べました。その結果、ドメイン固定SERCA2b変異体は、野生型と同様に、ATP結合能と加水分解活性を有していました。この結果から、今回クライオ電子顕微鏡により明らかとなったコンパクトな構造の状態でSERCA2bがATP分子を取り込むことが示されました。以上の研究より、小胞体カルシウムポンプのATP結合に関する新たなモデルを提唱するに至りました(図3)。
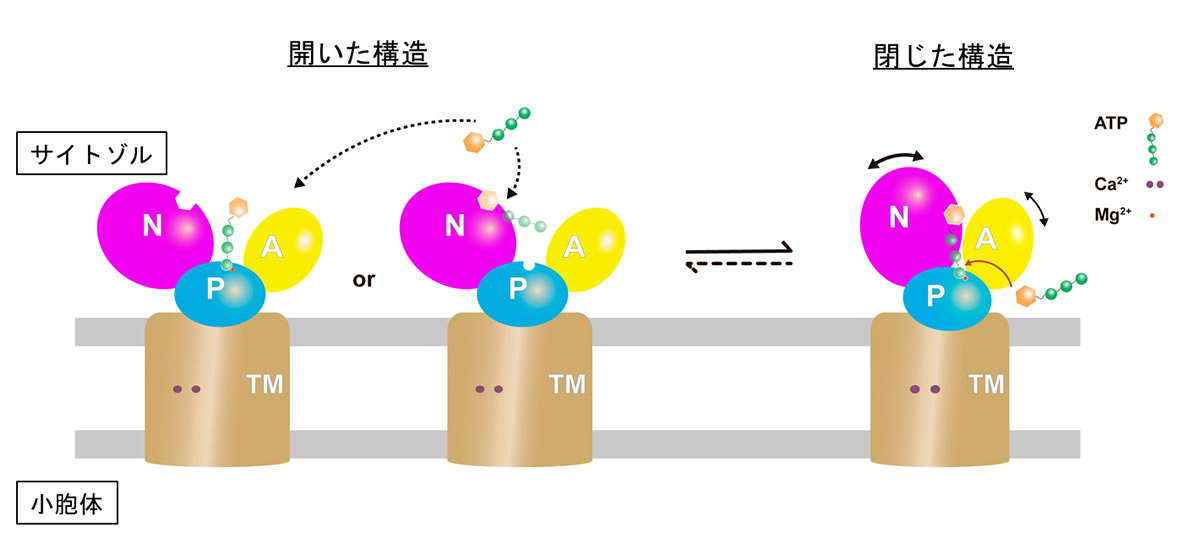
図3. 新しく提唱されたSERCAのATP結合メカニズム
従来ATPは、サイトゾル側ドメインが開いた構造(左)をとることでSERCAに結合すると考えられてきたが、本研究によりサイトゾル側ドメインが閉じた構造(右)でATPが正しい位置に結合し得ることが示された。サイトゾル側ドメインが閉じた状態では、ATPのアデノシン部位とγ-リン酸基部位の両方がSERCAと強く結合すると予想される。
今後の展開
本研究成果として、SERCA2bの反応サイクルにおいてATP分子を取り込む新たな分子機構が解明されました。従来の構造決定手法であるX線結晶構造解析と異なり、クライオ電子顕微鏡は、試料を結晶化する必要がないため、溶液状態の構造をおよそ正確に反映していると解釈できます。したがって、SERCAがATP結合前にサイトゾル側のドメインが大きく開いた状態の構造をとることを否定はしないものの、SERCAは主としてサイトゾル側のドメインが閉じたコンパクトな構造をとっており、その状態でATPと結合することが本研究より示唆されました。
今後は、SERCAと同じP型 ATPaseファミリー注5に属する他の金属イオンポンプも、同様にコンパクトな構造でATP分子を取り込むのかを調べ、本研究により提唱されたATP結合モデルの普遍性を探りたいと考えています。SERCA2bの遺伝子変異による機能不全が、ダリエ病注6という皮膚病を引き起こすことが広く知られ、また小胞体中のカルシウム枯渇が小胞体ストレスを誘起し、ひいては神経変性疾患や糖尿病を引き起こすことが知られています。したがって、本研究で得られた知見は、細胞内カルシウムが関わる種々の生命現象の解明のみならず、細胞のカルシウム恒常性維持機構の破綻が引き起こす様々な疾病の原因解明および治療戦略の開発につながることが期待されます。
|
本成果は、以下の事業・研究課題の支援によって得られました。 日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS) 課題名:クライオ電顕による細胞内ネイティブ複合体構造解析 代表者:吉川 雅英(東京大学 大学院医学系研究科 教授) |
論文情報:
Cryo-EM analysis provides new mechanistic insight into ATP binding to Ca2+-ATPase SERCA2b
Zhang. Y., Watanabe, S., Tsutsumi, A., Kadokura, H. Kikkawa, M. and Inaba, K.*
EMBO Journal
DOI:10.15252/embj.2021108482
用語解説
注1)クライオ電子顕微鏡単粒子解析:
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数万分子の投影像から高分解能の三次元構造を構築する。
注2)ATP:
別称、アデノシン三リン酸。分子内に高エネルギーリン酸結合を有しており、それが加水分解されることでエネルギーを放出する。ここで放出されたエネルギーは、エネルギーを要する様々な生体内作用に寄与する。地球上のほとんど全ての生物に普遍的に分布し、「生体エネルギーの通貨」とも呼ばれる。
注3)アイソフォーム:
基本的な機能に関する構造またはアミノ酸配列は同じだが、一部が異なっているタンパク質。異なる遺伝子から発現する。
注4)X線結晶構造解析:
分子の構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
注5)P型ATPaseファミリー:
ATP加水分解により生じるエネルギーを利用し、種々の金属イオンや水素イオンの膜を介した輸送、リン脂質の反転の機能などを有する。ATP加水分解の過程で、生じたリン酸基が一過的に本酵素に結合し、リン酸化された状態をとるという共通の性質がある。
注6)ダリエ病:
角質が正常に作られなくなり、かさぶたのついた褐色の丘疹が皮膚にたくさんできる皮膚病の一つ。小胞体へカルシウムイオンを輸送するカルシウムポンプSERCA2bの異常が原因で、常染色体優性の遺伝形式をとる。このSERCA2bがうまく機能しなくなることで細胞内のカルシウム濃度の異常が起こり、細胞間結合と表皮細胞分化に異常をきたすと考えられている。
関連リンク:
東北大学
東京大学大学院医学系研究科
国立研究開発法人日本医療研究開発機構(AMED)
東北大学 大学院 生命科学研究科
東北大学 大学院 理学研究科・理学部
生体分子構造研究分野(稲葉研究室)
問い合わせ先
東北大学多元物質科学研究所 教授
稲葉 謙次(いなば けんじ)
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5604
E-mail: kenji.inaba.a1*tohoku.ac.jp(*を@に置き換えてください)
(報道に関すること)
東北大学多元物質科学研究所 広報情報室(伊藤)
Tel: 022-217-5198
E-mail: press.tagen*grp.tohoku.ac.jp(*を@に置き換えてください)