発表のポイント
概要
東北大学 学際科学フロンティア研究所の奥村正樹助教、東北大学 多元物質科学研究所の稲葉謙次教授(生命科学研究科、大学院理学研究科化学専攻 兼任)、熊本大学 発生医学研究所の小椋光教授、野井健太郎博士(現 大阪大学 ナノサイエンスデザイン教育研究センター 特任助教)らの研究グループは、JST戦略的創造研究推進事業において、高速原子間力顕微鏡により、ジスルフィド結合導入酵素プロテインジスルフィドイソメラーゼ(PDI)が構造未成熟な基質を捕獲する様子を可視化することに世界で初めて成功し、同酵素によるたんぱく質の立体構造形成促進機構に関する全く新しい概念を提唱しました。
細胞内には、たんぱく質高次構造の形成反応を促進する仕組みがあります。特に構造未成熟なたんぱく質の構造修復の仕組みは、我々の生体内で不良たんぱく質の蓄積を防ぐために必要不可欠です。しかしながら、いまだどのようにして細胞内の補助因子が構造未成熟なたんぱく質を認識し、構造修復のため働いているのかよくわかっていませんでした。
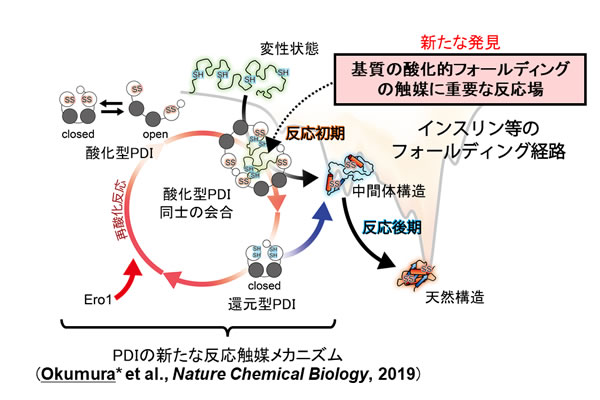
PDIファミリーたんぱく質の1つであるPDIは、哺乳動物細胞の小胞体内で、立体構造形成前のたんぱく質にジスルフィド結合を導入させたり誤って形成されたジスルフィド結合を修復したりなどの機能を担っています。PDIの結晶構造は4つのドメインから構成されるU字構造であり、動きに富むことが示唆されていましたが、この動きがPDIの機能発現にどう関わるか解明されていませんでした。
そこで、高速原子間力顕微鏡による1分子レベルでの観察により、PDIが酸化還元状態依存的にドメインの動きを制御していることを明らかにしました。さらに、BPTI、RNaseA、ラミニン、プラスミノーゲンといった形や大きさ、ジスルフィド結合の数が異なるさまざまな基質を還元変性させた状態で添加すると、PDIは二量体へ会合し、その中央に形成される空間(キャビティ)に基質が取り込まれる様子を観察することに世界で初めて成功しました。これにより、PDIが触媒するたんぱく質の酸化的フォールディングの全く新しいモデルを提唱するに至りました。
本研究成果は、2019年4月15日16時(英国時間)に「Nature Chemical Biology」のオンライン速報版で公開されました。
プレスリリース本文(PDF)
論文情報:
“Dynamic assembly of protein disulfide isomerase in catalysis of oxidative folding”
(酸化的フォールディング触媒におけるPDIの動的会合機構の解明)
Masaki Okumura, Kentaro Noi, Shingo Kanemura, Misaki Kinoshita, Tomohide Saio, Yu-ichi Inoue, Takaaki Hikima, Shuji Akiyama, Teru Ogura, and Kenji Inaba
Nature Chemical Biology, UK
DOI:10.1038/s41589-019-0268-8
関連リンク:
多元物質科学研究所 生体分子構造研究分野(稲葉研究室)
熊本大学
国立研究開発法人 科学技術振興機構(JST)
東北大学大学院理学研究科・理学部
東北大学 大学院 生命科学研究科
東北大学
問い合わせ先
多元物質科学研究所 教授
Tel:022-217-5604
E-mail:kinaba*tagen.tohoku.ac.jp(*を@に置き換えてください)