触媒のナノ粒子化と形態制御
村松淳司
(東北大学多元物質科学研究所)
1. 金属ナノ粒子
 液相から金属微粒子を析出させる反応はコロイド化学においてはかなり前から行われてきた.代表的なものとして有名なBredigによる単分散(粒子径分布が極めて狭い)白金コロイド溶液の製造1)が挙げられる.これは直径1〜2mmの白金を抵抗のついた直流電源の両極に配し,30〜100V程度の直流電圧を印加し,両極を短絡させて5〜10A程度の電流が流れるように抵抗値を調節すると先端が破砕されて,白金コロイドが生成するというものである.これは,金や銀のコロイド溶液を調製する際にも応用できる.これに対して化学的還元反応を伴う,溶液からの還元析出法もある.あまりにも有名なFaradayゾル2)は塩化金酸(HAuCl5)溶液を炭酸カリウムで中和し,黄リンのエーテル溶液で還元して得るものであり,平均粒径約6nmの金コロイドが生成する.Zsigmondy3)は塩化金酸の希薄水溶液をホルムアルデヒド(HCHO)で還元して金コロイドを,Paalら4)はヒドラジン(N2H4)を還元剤として白金,パラジウム,イリジウムの金属コロイドを調製した.鮫島5)は下記の方法で銀粒子を得ている.すなわち蒸発皿に0.002〜0.02%の硝酸銀水溶液を入れ,液面の上方からガスバーナーの炎の外炎の部分を液面にあてるもので,外炎に含まれる一酸化炭素によって銀が還元されて析出する.近年,Hiraiら6)は塩化ロジウムからメタノールを還元剤に用いて金属ロジウムコロイド(平均粒径4nm)を得た.以上はいずれも貴金属コロイドの製造法であり,溶液中の金属イオンの還元析出という機構は同一である.中尾ら7)は生成した一次粒子を高分子物質で覆うという画期的な方法を採用し,30〜50 nm程度のニッケルボライド微粒子の合成に成功している.また同じ研究者によって,界面活性剤を保護コロイド的に使用することで数10nm程度のRh,Pt,Ag,Au等の貴金属コロイドを安定性よく合成している8).同様な金属コロイド触媒はToshimaらによって精力的に研究されている9)が,これは別項で詳細に述べられると思うので本項では割愛する.
液相から金属微粒子を析出させる反応はコロイド化学においてはかなり前から行われてきた.代表的なものとして有名なBredigによる単分散(粒子径分布が極めて狭い)白金コロイド溶液の製造1)が挙げられる.これは直径1〜2mmの白金を抵抗のついた直流電源の両極に配し,30〜100V程度の直流電圧を印加し,両極を短絡させて5〜10A程度の電流が流れるように抵抗値を調節すると先端が破砕されて,白金コロイドが生成するというものである.これは,金や銀のコロイド溶液を調製する際にも応用できる.これに対して化学的還元反応を伴う,溶液からの還元析出法もある.あまりにも有名なFaradayゾル2)は塩化金酸(HAuCl5)溶液を炭酸カリウムで中和し,黄リンのエーテル溶液で還元して得るものであり,平均粒径約6nmの金コロイドが生成する.Zsigmondy3)は塩化金酸の希薄水溶液をホルムアルデヒド(HCHO)で還元して金コロイドを,Paalら4)はヒドラジン(N2H4)を還元剤として白金,パラジウム,イリジウムの金属コロイドを調製した.鮫島5)は下記の方法で銀粒子を得ている.すなわち蒸発皿に0.002〜0.02%の硝酸銀水溶液を入れ,液面の上方からガスバーナーの炎の外炎の部分を液面にあてるもので,外炎に含まれる一酸化炭素によって銀が還元されて析出する.近年,Hiraiら6)は塩化ロジウムからメタノールを還元剤に用いて金属ロジウムコロイド(平均粒径4nm)を得た.以上はいずれも貴金属コロイドの製造法であり,溶液中の金属イオンの還元析出という機構は同一である.中尾ら7)は生成した一次粒子を高分子物質で覆うという画期的な方法を採用し,30〜50 nm程度のニッケルボライド微粒子の合成に成功している.また同じ研究者によって,界面活性剤を保護コロイド的に使用することで数10nm程度のRh,Pt,Ag,Au等の貴金属コロイドを安定性よく合成している8).同様な金属コロイド触媒はToshimaらによって精力的に研究されている9)が,これは別項で詳細に述べられると思うので本項では割愛する.
 液相で還元剤を用いて金属イオンから金属を得る手法は,材料工学においては無電解めっき(化学めっき)法としてよく知られる.この方法は膜磁気ディスクなどの金属膜生成の手法として応用が期待されており10),また基板を選ばないことや非晶質膜が容易に得られることなど電解めっきにはない特徴11)を有し,最近では水素吸蔵合金の表面処理法として広く利用されている.無電解めっきは基板の表面に膜を作成するという点で,微粒子の調製とは一見無関係のような感があるが,金属イオンの還元,核の生成,成長の過程は微粒子調製のそれと同じであり,生成した金属が付着する基板があるか否かの違いだけであり,無電解めっきを微粒子作成に応用できる12).
液相で還元剤を用いて金属イオンから金属を得る手法は,材料工学においては無電解めっき(化学めっき)法としてよく知られる.この方法は膜磁気ディスクなどの金属膜生成の手法として応用が期待されており10),また基板を選ばないことや非晶質膜が容易に得られることなど電解めっきにはない特徴11)を有し,最近では水素吸蔵合金の表面処理法として広く利用されている.無電解めっきは基板の表面に膜を作成するという点で,微粒子の調製とは一見無関係のような感があるが,金属イオンの還元,核の生成,成長の過程は微粒子調製のそれと同じであり,生成した金属が付着する基板があるか否かの違いだけであり,無電解めっきを微粒子作成に応用できる12).
一方,貴金属以外の金属に目を向けると液相懸濁槽式反応器に用いる触媒の調製法の一つとして,液相還元法を用いることがある.これは水溶液中あるいは非水溶液中でニッケルあるいはコバルトイオンが水素化ホウ素ナトリウム(NaBH4)などの金属ヒドリド(水素化物)により還元を受けてニッケルボライド(ホウ化物)あるいはコバルトボライドが固相として析出するというものである.用いられる還元剤,金属ヒドリドのうち,代表的なものが,水素化ホウ素ナトリウムと水素化アルミニウムリチウム(LiAlH4)である.前者は溶媒として水を使用できるが,後者の場合はその強い還元力のために水分子から酸素を引き抜く反応が起こり水素が発生するので,水は溶媒として使用できない.逆に水素化ホウ素ナトリウムでアルコールを溶媒にする場合は注意を要する.また,ヒドラジン(N2H4)は中程度の還元力を有し,水溶媒も使用可能であり,さらには得られる微粒子中にホウ素やアルミニウム等の不純物が混入することもないので,優れた還元剤といえよう.これらの還元剤はもともと有機化学の分野でアルデヒドやケトンの水素化用反応剤として使用されているもので,還元剤の作用機構に関しては成書13)を参照されたい.また,液相還元法では,使用する溶媒に溶けうる金属塩であれば,2種以上の複合化は極めて容易であり,合金超微粒子の製造も可能である.
 Paulら14)は種々のニッケル塩水溶液に水素化ホウ素カリウムあるいは水素化ホウ素ナトリウムを作用させて得られたニッケルボライドの構造はNi2Bであり,磁性や発火性が認められなかったと報告している.また,Brownらはエタノール溶液中で酢酸ニッケル(Ni(OCOCH3)2)に水素化ホウ素ナトリウムを作用させてニッケルボライドを合成し,オレフィンの水素化反応に対して極めて高い触媒選択性が得られた15-17)としている.Mearsら18)はニッケルボライド触媒が2-プロパノール(CH3-CH(OH)-CH3)の脱水反応によるアセトン生成の反応に高い活性を示したと述べ,このNi2B構造のニッケルボライドはアモルファスであると報告している.さらに,Hoferら19)やFlechonら20)も,ニッケル塩に水素化ホウ素ナトリウムを作用させて得た微粒子はアモルファス状態であり,250 ℃以上で熱処理をすると結晶化するとしている.Mayburyら21)は窒素気流中で注意深くニッケル塩あるいはコバルト塩のエタノール溶液に水素化ホウ素ナトリウムを作用させて,ニッケルボライドあるいはコバルトボライド粒子を合成したが,得られた粒子は(Co2B)5・H3,(Ni2B)2・H3の組成で表せるほどの多量の水素を含有していたと報告している.また,筆者らも図3のように水素含有アモルファスニッケルボライドを合成している22-24).Schaefferら25)はジエチルエーテル中,塩化第二鉄に水素化アルミニウムリチウムを作用させて,金属アルミニウム含有金属鉄微粒子を調製した.武上ら26-27)は同様な塩化第二鉄−水素化アルミニウムリチウム−エーテル系で得た鉄粒子をオレフィンの水素化触媒として使用した.Riekeらは29-31),有機溶媒中ニッケルなどの金属粉を金属状態のカリウムやナトリウムなどのアルカリ金属で直接還元して合成する手法を紹介し,さらに生成したニッケル,コバルト,鉄の金属粉を容易に有機金属化合物に転化できるとし,均一系触媒への利用の道を開拓した32,33).
Paulら14)は種々のニッケル塩水溶液に水素化ホウ素カリウムあるいは水素化ホウ素ナトリウムを作用させて得られたニッケルボライドの構造はNi2Bであり,磁性や発火性が認められなかったと報告している.また,Brownらはエタノール溶液中で酢酸ニッケル(Ni(OCOCH3)2)に水素化ホウ素ナトリウムを作用させてニッケルボライドを合成し,オレフィンの水素化反応に対して極めて高い触媒選択性が得られた15-17)としている.Mearsら18)はニッケルボライド触媒が2-プロパノール(CH3-CH(OH)-CH3)の脱水反応によるアセトン生成の反応に高い活性を示したと述べ,このNi2B構造のニッケルボライドはアモルファスであると報告している.さらに,Hoferら19)やFlechonら20)も,ニッケル塩に水素化ホウ素ナトリウムを作用させて得た微粒子はアモルファス状態であり,250 ℃以上で熱処理をすると結晶化するとしている.Mayburyら21)は窒素気流中で注意深くニッケル塩あるいはコバルト塩のエタノール溶液に水素化ホウ素ナトリウムを作用させて,ニッケルボライドあるいはコバルトボライド粒子を合成したが,得られた粒子は(Co2B)5・H3,(Ni2B)2・H3の組成で表せるほどの多量の水素を含有していたと報告している.また,筆者らも図3のように水素含有アモルファスニッケルボライドを合成している22-24).Schaefferら25)はジエチルエーテル中,塩化第二鉄に水素化アルミニウムリチウムを作用させて,金属アルミニウム含有金属鉄微粒子を調製した.武上ら26-27)は同様な塩化第二鉄−水素化アルミニウムリチウム−エーテル系で得た鉄粒子をオレフィンの水素化触媒として使用した.Riekeらは29-31),有機溶媒中ニッケルなどの金属粉を金属状態のカリウムやナトリウムなどのアルカリ金属で直接還元して合成する手法を紹介し,さらに生成したニッケル,コバルト,鉄の金属粉を容易に有機金属化合物に転化できるとし,均一系触媒への利用の道を開拓した32,33).
筆者らは,ニッケルアセチルアセトネート(Ni(CH3COCHCOCH3)2)を出発物質として2-プロパノール溶媒中水素化ホウ素ナトリウムを作用させるか,テトラヒドロフラン(THF;-CH2-CH2-CH2-CH2-O-)溶媒中水素化アルミニウムリチウムを作用させてアモルファスニッケル金属超微粒子を合成した23).生成した金属コロイド溶液は,6ヶ月以上黒色コロイド溶液の状態で安定分散した24).後者の方法で合成したニッケル金属超微粒子の平均粒子径は約50nmであった.この手法を貴金属微粒子触媒調製に応用した34).
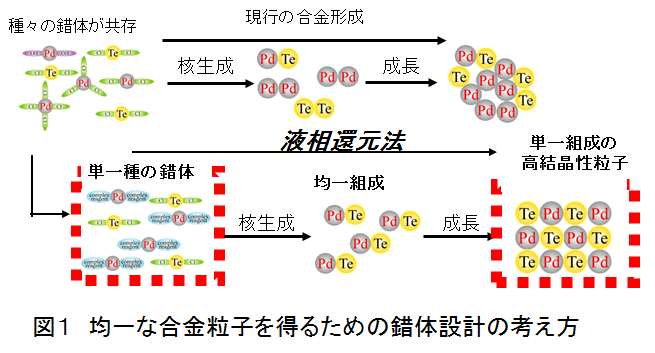
 貴金属微粒子触媒のPdTeは金属間化合物であり,広義の合金の一種である.この組成を精密にひとつの組成に制御する(たとえばPd:Te=1:1とするような合金組成)のは容易ではないが,触媒に供するには合金組成の効果が一般には無視できないため,厳密に組成制御可能な触媒調製法が望まれる.通常,金属塩溶液は複数の錯体が平衡組成で共存するような系であり,それぞれの錯体の酸化還元電位が異なることから還元反応は一様には進まない.これがPd単独の系ならばPd粒子のサイズが揃わない程度の問題で終わるが,合金の系になるとその組成まで影響するので,前駆錯体溶液は個々の金属の錯体において,唯一であることが要求される.概念図1のように溶液内に存在する錯体をただ1種類のものに限定できれば,核生成と成長の段階が整理され,組成,構造,サイズなどが均一な粒子群を作成できる.この錯体の設計こそ,合金ナノ粒子合成の最初に要求される必要不可欠な条件となる.
貴金属微粒子触媒のPdTeは金属間化合物であり,広義の合金の一種である.この組成を精密にひとつの組成に制御する(たとえばPd:Te=1:1とするような合金組成)のは容易ではないが,触媒に供するには合金組成の効果が一般には無視できないため,厳密に組成制御可能な触媒調製法が望まれる.通常,金属塩溶液は複数の錯体が平衡組成で共存するような系であり,それぞれの錯体の酸化還元電位が異なることから還元反応は一様には進まない.これがPd単独の系ならばPd粒子のサイズが揃わない程度の問題で終わるが,合金の系になるとその組成まで影響するので,前駆錯体溶液は個々の金属の錯体において,唯一であることが要求される.概念図1のように溶液内に存在する錯体をただ1種類のものに限定できれば,核生成と成長の段階が整理され,組成,構造,サイズなどが均一な粒子群を作成できる.この錯体の設計こそ,合金ナノ粒子合成の最初に要求される必要不可欠な条件となる.
まず,錯化剤を入れずにそのままの場合は,還元剤投入により急激に黒色化し,ただちに凝集粒子が生成してしま.目的の単一の合金相は得られず,主にPd単独の金属を中心に,種々の合金相が共存した多結晶体が生成する.そのため,触媒設計のためにまずは錯体平衡計算を実施する.これは水溶液内に存在する錯体がpHによってどう変化するのか予測しようとするものである.具体的な平衡濃度計算に用いたデータを図2に示した.錯化剤によってはデータのない場合があるので,実際の平衡実験結果を踏まえなければならないが,代表的な錯化剤については錯体平衡のデータ集35)にあるので参照されたい.
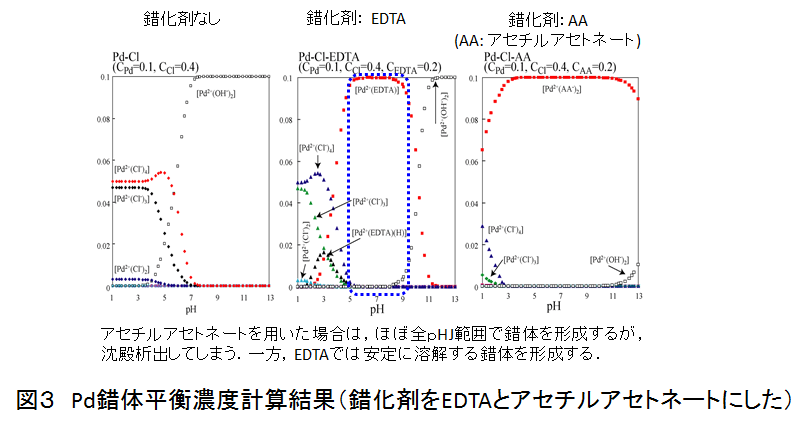
濃度計算で実際に単一の錯体が得られるpH範囲が分かったら,その錯体が溶解できるかどうかを確認する.せっかく単一錯体が得られることが予想されても実際に溶けなかったら,液相還元法の前駆体としては使用できないので,実験的に必ず確認する.図3は,Pd錯体平衡濃度計算結果(錯化剤をEDTAとアセチルアセトネートにした)であり,このうちアセチルアセトネートは溶解しないことが別途実験的に確認された.
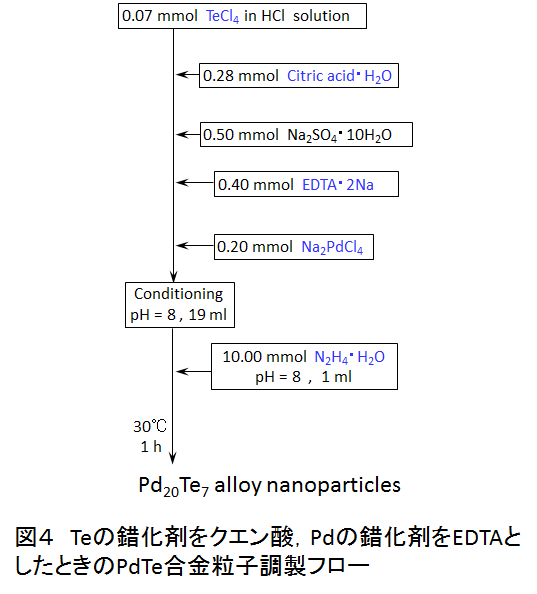
 図4は,PdTe合金粒子合成のうち,最終的に確立されたPd20Te7合金微粒子の合成フローである.Teの錯体平衡濃度計算のデータがないため,実験的にクエン酸を選び出した.Pdの錯化剤はEDTAを採用している.実際に合成実験を行うと,pH1及び3の場合は多数の金属や合金粒子の混合物となるが,5<pH<10の条件化ではPd20Te7のみとなった.酸性領域では水溶液中で様々な種類の錯体が存在するため錯体の種類ごとに異なった還元反応速度を持つことやヒドラジンの還元力が酸性領域では弱く未反応のPd錯体が残留する.5<pH<10の領域では錯体濃度計算結果から明らかなように,1種類の錯体のみが存在し,単一の還元反応速度を持つことから均質なPdTe合金が得られた(図5).図中にはHR-TEM/EDXによる1粒子中のPd及びTeの含有量測定結果も示したが,1つの粒子中にPdとTeが共存しており,その比率はほぼ均一であることがわかる.若干Te含有量は少ないものの,本手法を用いることで結晶性が高く均質なPd20Te7合金微粒子が合成できる.
図4は,PdTe合金粒子合成のうち,最終的に確立されたPd20Te7合金微粒子の合成フローである.Teの錯体平衡濃度計算のデータがないため,実験的にクエン酸を選び出した.Pdの錯化剤はEDTAを採用している.実際に合成実験を行うと,pH1及び3の場合は多数の金属や合金粒子の混合物となるが,5<pH<10の条件化ではPd20Te7のみとなった.酸性領域では水溶液中で様々な種類の錯体が存在するため錯体の種類ごとに異なった還元反応速度を持つことやヒドラジンの還元力が酸性領域では弱く未反応のPd錯体が残留する.5<pH<10の領域では錯体濃度計算結果から明らかなように,1種類の錯体のみが存在し,単一の還元反応速度を持つことから均質なPdTe合金が得られた(図5).図中にはHR-TEM/EDXによる1粒子中のPd及びTeの含有量測定結果も示したが,1つの粒子中にPdとTeが共存しており,その比率はほぼ均一であることがわかる.若干Te含有量は少ないものの,本手法を用いることで結晶性が高く均質なPd20Te7合金微粒子が合成できる.
2. 酸化物ナノ粒子の形態制御
次に,触媒粒子の形態制御化し,触媒活性への効果を調べた例を示す.
種々の形態の酸化チタン(チタニア,アナタース型)ナノ粒子を,ゲル−ゾル法36)で合成する.このゲル−ゾル法の要点は次の通りである.37)
1) 固相前駆体の溶質濃度はLaMerモデル38,39)に従い,十分に下げ,制御できる範囲とする.
 2) 前駆体溶質の供給源を別途用意する.
2) 前駆体溶質の供給源を別途用意する.
3) 濃厚溶液中で粒子が凝集しないようにする.
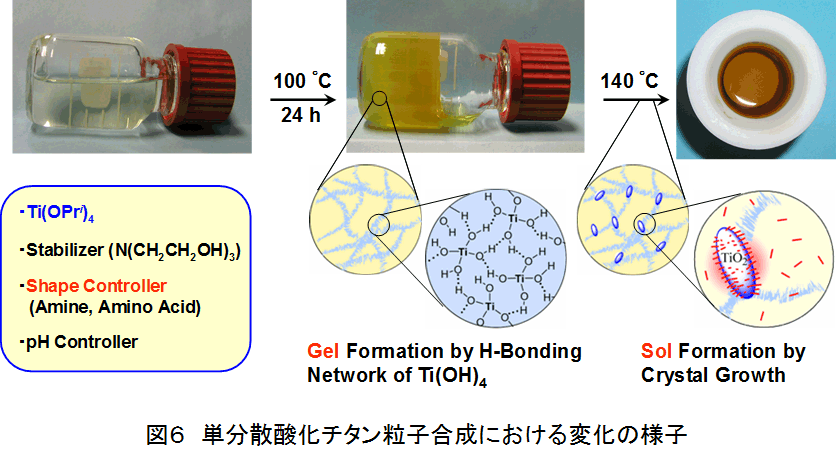
であり,いずれも難解な技術を伴っており,これを酸化チタン合成に適用する.この方法のポイントは3つある.図6には合成の様子を示した.
1) 空気中で加水分解しやすいチタンイソプロポキシド(チタンのアルコキシド)に2倍モルのトリエタノールアミンを加え,安定なチタン錯体にすること (図6の最左の写真)
2) 0.25 mol dm-3 [Ti4+] + 0.50 mol dm-3 トリエタノールアミン + 1.0 mol dm-3 NH3の混合溶液を,100℃1日経時して,水酸化チタンゲルを生成(1段目).このゲルはチタニア前駆体の供給源となり,かつチタニア粒子の凝集を防止している. (図6の真中の写真)
3) 続いて140℃3日経時して,チタニア粒子を合成(2段目の経時) (図6の右の写真)
 図7はこの変換の様子をTEMで見たものであり,これより (a) 0, (b) 1日, (c) 2日, (d) 3日と,不定形の水酸化チタンゲルが,スピンドル型のチタニア粒子に相転移することがわかる.この相転移は後述するように,溶液経由,すなわちゲルの溶解とチタニア粒子上への再析出で進行している.第1段目の経時がないと溶液相のチタン濃度が高いまま,ゲルの生成と同時にチタニアの核生成が進行して,核生成と成長の分離ができず,かつ,凝集した粒子が生成してしまう.生成した粒子は高分解能電子顕微鏡で観察すると,単結晶であることがわかった.スピンドル形状をとるのはアンモニアによる形態制御効果であると説明されている40).
図7はこの変換の様子をTEMで見たものであり,これより (a) 0, (b) 1日, (c) 2日, (d) 3日と,不定形の水酸化チタンゲルが,スピンドル型のチタニア粒子に相転移することがわかる.この相転移は後述するように,溶液経由,すなわちゲルの溶解とチタニア粒子上への再析出で進行している.第1段目の経時がないと溶液相のチタン濃度が高いまま,ゲルの生成と同時にチタニアの核生成が進行して,核生成と成長の分離ができず,かつ,凝集した粒子が生成してしまう.生成した粒子は高分解能電子顕微鏡で観察すると,単結晶であることがわかった.スピンドル形状をとるのはアンモニアによる形態制御効果であると説明されている40).
上述の方法を用いて,不定形,アスペクト比を変化させた 2 種類のスピンドル状および立方体状の 4 種類の粒子を合成した.この際,スピンドル状粒子のアスペクト比は種粒子を用いることで変化させた.また,得られた粒子は 400℃ で 3 時間空気中で熱処理を行うことにより,形態変化を伴わずに表面上の有機物を除去した.Ni 担持は液相還元選択析出法41)により行い,Ni 担持酸化チタンナノ粒子 Ni/TiO2を得た.光触媒活性は,10 vol.% エタノール水溶液中に Ni/TiO2 を 10.0 mg 分散させて評価した.
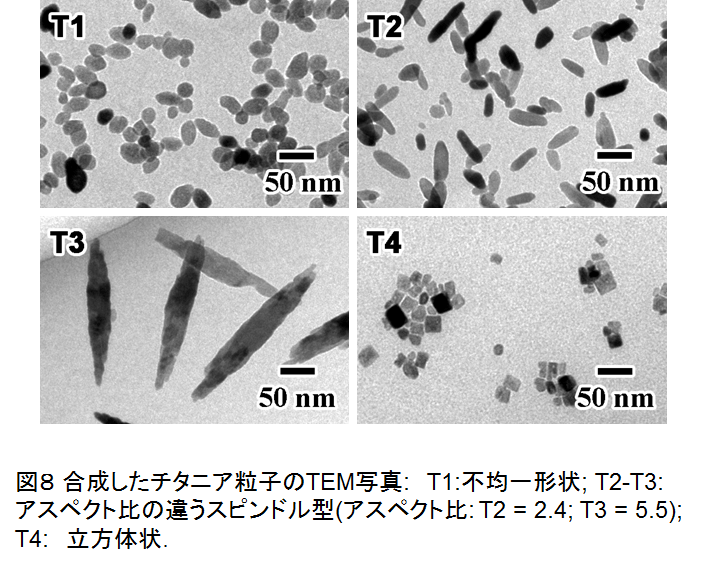 合成した不定形 T1, アスペクト比の異なる 2 種類のスピンドル状 T2 と T3, および立方体状酸化チタンナノ粒子 T4 の TEM 像を図8に示す.TEM 像から計算した T2, T3 のアスペクト比はそれぞれ2.4, 5.5 であった.また,XRD 測定結果から,合成した粒子はいずれもアナタース型酸化チタン単相であることが分かった.図9に T4 の HRTEM 像・FFT 像を示す.この結果,T4 は{100} 面と {001} 面で囲まれた立方体状粒子であることが分かった.一方,T2, T3 は c 軸方向に異方成長していることが分かり,{100}, {101} 面が多く露出した粒子であった.光触媒活性を評価したところ,Ni/T4 が最も高い光触媒活性を示し,一般的なアナタース型酸化チタンである ST-01 の 2.7 倍,Ni/T3 の 6.6 倍という高い光触媒活性を示した.これは T4 が {001} 面を多く露出しているためであると考えられ,{001} 面が非常に高い活性を示すことが示唆された42).こうした光触媒における本プロセスの律速段階である水素生成においては予想通り,結晶面依存性があることが明らかになった.
合成した不定形 T1, アスペクト比の異なる 2 種類のスピンドル状 T2 と T3, および立方体状酸化チタンナノ粒子 T4 の TEM 像を図8に示す.TEM 像から計算した T2, T3 のアスペクト比はそれぞれ2.4, 5.5 であった.また,XRD 測定結果から,合成した粒子はいずれもアナタース型酸化チタン単相であることが分かった.図9に T4 の HRTEM 像・FFT 像を示す.この結果,T4 は{100} 面と {001} 面で囲まれた立方体状粒子であることが分かった.一方,T2, T3 は c 軸方向に異方成長していることが分かり,{100}, {101} 面が多く露出した粒子であった.光触媒活性を評価したところ,Ni/T4 が最も高い光触媒活性を示し,一般的なアナタース型酸化チタンである ST-01 の 2.7 倍,Ni/T3 の 6.6 倍という高い光触媒活性を示した.これは T4 が {001} 面を多く露出しているためであると考えられ,{001} 面が非常に高い活性を示すことが示唆された42).こうした光触媒における本プロセスの律速段階である水素生成においては予想通り,結晶面依存性があることが明らかになった.
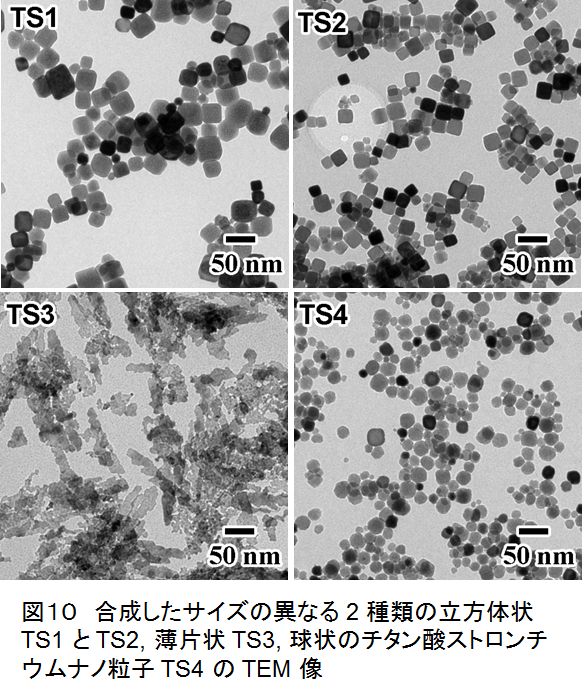
 さらに同様な形態効果について,チタン酸ストロンチウムナノ粒子を例にとって検討した.やはりゲル−ゾル法を応用して合成した.まず,チタンテトライソプロポキシドにトリエタノールアミンを加えて Ti 前駆体溶液を調製した.次に,前駆体溶液に等体積の水またはエチレングリコール,ジエチレングリコール,トリメチレングリコールなどを加え,最後に水酸化ストロンチウム八水和物を加え,室温で 1.5 時間撹拌することでゲルを得た.その後,得られたゲルをテフロン容器に移し入れ,オートクレーブで 140℃,3 日間加熱し,サイズの異なる2 種類の立方体状,薄片状,および球状の4 種類のチタン酸ストロンチウムナノ粒子を合成した.合成したサイズの異なる 2 種類の立方体状 TS1 とTS2, 薄片状 TS3, 球状のチタン酸ストロンチウムナノ粒子 TS4 の TEM 像を図10に示す.TEM 像から計算した TS1, TS2, TS4 の平均粒子径はそれぞれ,43±10 nm, 30±7 nm, 28±7 nm であった.また,XRD測定結果から,合成した粒子はいずれもチタン酸ストロンチウム単相であることが分かった.高解像度 TEM 観察・電子線回折結果から,TS1およびTS2 は{100} 面で囲まれた立方体状粒子であることが分かった.一方,TS3 は c 軸方向に異方成長していることが分かり,{110} 面が多く露出した粒子であった.光触媒活性を評価したところ,Pt/TS3 が最も高い活性を示し,Pt/TS1 の 1.3 倍,Pt/TS4 の 1.7 倍であった.一方で,TS2 は TS1 と比較し,比表面積が 2 倍であるにも関わらず TS1 と同程度の光触媒活性を示した.これらの結果から,メタノール水溶液からの水素生成反応においては比表面積よりも露出する結晶面の違いが光触媒活性に大きな影響を与えると考えられる.TS3 は {110} 面を多く露出していることから,{110} 面が非常に高い活性を示すことが示唆された.
さらに同様な形態効果について,チタン酸ストロンチウムナノ粒子を例にとって検討した.やはりゲル−ゾル法を応用して合成した.まず,チタンテトライソプロポキシドにトリエタノールアミンを加えて Ti 前駆体溶液を調製した.次に,前駆体溶液に等体積の水またはエチレングリコール,ジエチレングリコール,トリメチレングリコールなどを加え,最後に水酸化ストロンチウム八水和物を加え,室温で 1.5 時間撹拌することでゲルを得た.その後,得られたゲルをテフロン容器に移し入れ,オートクレーブで 140℃,3 日間加熱し,サイズの異なる2 種類の立方体状,薄片状,および球状の4 種類のチタン酸ストロンチウムナノ粒子を合成した.合成したサイズの異なる 2 種類の立方体状 TS1 とTS2, 薄片状 TS3, 球状のチタン酸ストロンチウムナノ粒子 TS4 の TEM 像を図10に示す.TEM 像から計算した TS1, TS2, TS4 の平均粒子径はそれぞれ,43±10 nm, 30±7 nm, 28±7 nm であった.また,XRD測定結果から,合成した粒子はいずれもチタン酸ストロンチウム単相であることが分かった.高解像度 TEM 観察・電子線回折結果から,TS1およびTS2 は{100} 面で囲まれた立方体状粒子であることが分かった.一方,TS3 は c 軸方向に異方成長していることが分かり,{110} 面が多く露出した粒子であった.光触媒活性を評価したところ,Pt/TS3 が最も高い活性を示し,Pt/TS1 の 1.3 倍,Pt/TS4 の 1.7 倍であった.一方で,TS2 は TS1 と比較し,比表面積が 2 倍であるにも関わらず TS1 と同程度の光触媒活性を示した.これらの結果から,メタノール水溶液からの水素生成反応においては比表面積よりも露出する結晶面の違いが光触媒活性に大きな影響を与えると考えられる.TS3 は {110} 面を多く露出していることから,{110} 面が非常に高い活性を示すことが示唆された.
3. 今後の展望
触媒粒子のナノサイズ化や形態制御化は,液相合成法で比較的簡単にできる手法ではあるが,対象となる金属や金属酸化物は,出発原料やプロセスの制約上どうしても限られてくる.またどの結晶面が最も触媒活性が高いかも未だ経験則に依っている.材料供給側はオーダーメードのナノ粒子を提供できる体制を整え,供給される側は活性試験の結果をフィードバックさせることで,そうしたナノ触媒粒子データベースを作成することが,今後ますます重要と思われる.
文献
1) G. Bredig: Z. Electrochem., 4 (1898), 514.
2) M. Faraday: Philos. Mag., 147 (1857), 145.
3) R. Zsigmondy, R.: Z. Anal. Chem., 40 (1901), 697.
4) C. Paal and C. Amberger: Ber. Dtsch. Chem. Ges, 37 (1904), 124.
5) 鮫島実三郎: 日本化学雑誌,54 (1933), 695.
6) H. Hirai, Y. Nakao, N. Toshima, and K. Adachi: Chem. Lett., 1976, 905.
7) 中尾幸道,帰山享二:日本化学会誌, 1984, 1005.
8) Y. Nakao and K. Kaeriyama: J. Colloid Interface Sci., 110 (1986), 82.
9) 戸嶋直樹,金属・有機物ハイブリッドナノ構造体の触媒作用,「触媒活用大事典」,御園生 誠監修,工業調査会,(2004),III, 1.3, pp. 853-858.
10) 逢坂哲彌,後藤文男:表面,23 (1985), 138
11) 渡辺 徹,田辺良美:日本金属学会誌, 39 (1975), 831.
12) 中塚勝人:資源と素材,105 (1989), 71.
13) H.O. House, : Modern Synthetic Reactions, 2nd edition, (1972), 47, W.A. Benjamin, Inc.
14) R. Paul, P. Buisson, and N. Joseph: Ind.
15) H.C. Brown and
16) H.C. Brown and
17)
18) D.E. Mears and M. Boudart: A. I. Ch. E. Journal, 12 (1966), 313.
19) L.J.E. Hofer, J.E. Schultz, R.D. Panson, and R.B. Anderson: Inorg. Chem., 3 (1964), 1783.
20) J. Flechon and F.-A. Kuhnast: Academic Sci., Ser.3, 274 (1972), 707.
21) P.C. Maybury, R.W. Mitchell, and M.F. Hawthorne: J. Chem. Soc., Chem. Commun., 1974, 534.
22) 村松淳司,坂田和夫,佐々木弘,臼井進之助: 東北大学選研彙報, 46 (1990), 9.
23) 村松淳司,設楽修一,佐々木弘,臼井進之助: 資源と素材, 106 (1990), 799.
24) 村松淳司,佐々木弘,臼井進之助: 素材物性学雑誌, 5 (1992), 59.
25) G.W. Schaeffer, J.S. Roscoe, and A.C. Stewart: J. Am. Chem. Soc., 78 (1956), 729.
26) 武上善信,上野徹:工業化学雑誌, 67 (1964), 246.
27) 武上善信,上野徹,藤井隆雄:触媒, 8 (1966), 54.
28) 上野徹:触媒, 12 (1970), 115.
29) R.D. Rieke and P.H. Huhnall: J. Am. Chem. Soc., 94 (1972), 7178.
30) L. Chao and R.D. Rieke: J. Organometal. Chem., 67 (1974), C64.
31) L. Chao and R.D. Rieke: J. Org. Chem., 40 (1975), 2253.
32) R.D. Rieke: Acc. Chem. Res., 10 (1977), 301.
33) A.V. Kavaliunas and R.D. Rieke: J. Am. Chem. Soc., 192 (1980), 5944.
34) Y. Sunagawa, K. Yamamoto, H. Takahashi, and A. Muramatsu: Catalysis Today,132 (2008) 81.
35) たとえばhttp://www.acadsoft.co.uk/ The IUPAC Stability Constants Database, SC-Database.
36) T. Sugimoto, X. Zhou, A. Muramatsu, J. Colloid Interface Sci., 259, 53 (2003).
37) T. Sugimoto, K. Sakata, and A. Muramatsu: J. Colloid Interface Sci. 159, (1993) 372.
38) V. K. LaMer and R. Dineger: J. Am. Chem. Soc., 72 (1950), 4847.
39) V. K. LaMer: Ind. Eng. Chem., 44 (1952), 1270.
40) T. Sugimoto, M. Okada, and H. Itoh: J. Colloid Interface Sci. 193 (1997) 140.
41) H. Takahashi, Y. Sunagawa, S. Myagmarjav, A. Muramatsu, Catal. Survey Asia, 9, 187 (2005).
42) T. Kimijima, T. Sasaki, M. Nakaya, K. Kanie, A. Muramatsu, Chem. Lett., 39, 1080 (2010).