|
|
| ひとりごと その11 |
| 2010年10月27日(水)考察 |
| さらなる考察と解説 「中山平湯豆腐の完成は近い!」 |
なぜ、玉鳴号では嬉野温泉のようにはいかないのか。
そのため、中山平のほかの温泉水についても実験をおこなったわけである。
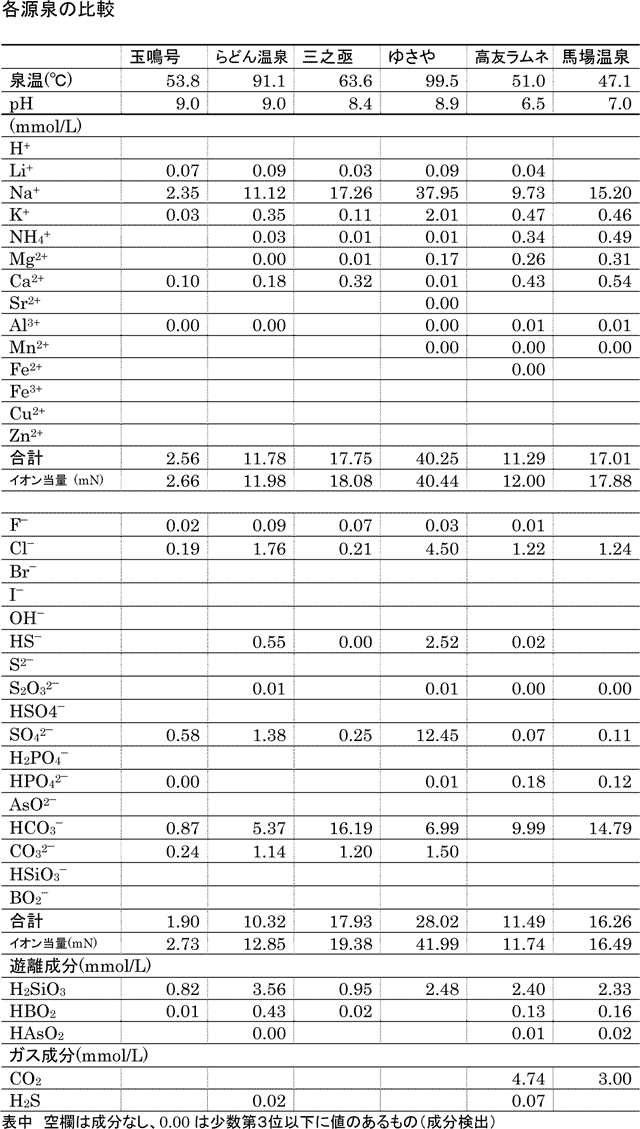
下の表は、玉鳴号、ラドン温泉源泉と、重曹泉として知られる、同じ中山平の三之亟の成分比較である。
参考までに、鳴子温泉のつるつるの触感で有名なウナギ湯「ゆさや」、東鳴子で炭酸がいっぱい出ることで知られる高友旅館のラムネ湯、それにやはり重曹泉で有名な、馬場温泉とも、比較している。
なお、表中の各イオン濃度値は、浴室に掲げてあるような mg/kg単位ではなく、物理化学的考察が可能な、mmol/L単位になっているので、注意が必要である。
この温泉成分の比較には、屋代氏のweb「湯けむりの町」のデータを使わせていただいた。
ここに深く感謝申し上げる。
(上記のpdfファイルが必要な場合はこちら)
|
pHの比較
各温泉をpHで比較してみると、玉鳴号、ラドン温泉ともに、pH 9くらいで、三之亟が若干下がる。この辺のpHの値はかなり敏感であり、意味があるので、このくらいの差も重要である。
「ゆさや」うなぎ湯もさすが、pHは9である。
pH 9は、NaOH(水酸化ナトリウム)溶液でいうと、約 0.01 mmol/Lくらいの濃度であり、は入浴感としては、つるつる感が若干ある程度だ。
つるつるする理由は、皮膚の角質層をやや溶かすといわれているが、pH 9では大したことはない。
豆腐が溶けるかどうかについても、pHは必要条件ではあるが、十分条件ではない。つまり、pH 9だから必ず溶けるか、というとそうではないのだ。
ただ、ほかの要素がそろっていても、pHが8以下となると、溶けない。
だから、実験はしていないが、pHが7より低い、高友のラムネ泉や、馬場温泉では溶けないだろう。
炭酸系イオン
鉱泉分析法指針の時代から、炭酸系のイオンの扱いでは基本的に詳細分析をしてきた。
成分表には、HCO3-, CO32-, CO2の3種のものが現れてきている。
この3つは、物理化学的にいえば、「同じもの」なので、溶液の条件で、お互いに変わるのである。
1)炭酸イオンが水に溶ける反応
この逆は水から炭酸ガスが出る反応であり、ラムネ泉と同じ
CO2 + H2O ⇔ H2CO3
2)炭酸が、炭酸水素イオンに解離する反応
水素イオンH+を放出するので、酸性ではおきない。弱アルカリ性のとき顕著。
H2CO3 ⇔ HCO3- + H+
3)炭酸水素イオンが、炭酸イオンに解離する反応
水素イオンH+をさらに放出する反応で、よりアルカリ性が高いときにおこる
HCO3- ⇔ CO32- + H+
pHは「水素イオンの活量」の逆数の常用対数である。ただ、温泉水の場合はpH 2~12の間にあることが多いので、「水素イオンの活量」を「水素イオン濃度」と読み替えてもよい。
これを物理化学では、理想溶液とみなす、という。
つまり、pHが低いときには、水素イオン濃度が高いので、2,3の反応は不利となり、逆反応が有利なのだ。
上の3つの式(これをイオン平衡式という)を眺めてみると、高友旅館のラムネ泉は、pHが7付近にあるので、アルカリ性と違って、1)の式の逆反応(左方向の反応)が進み、炭酸ガスCO2が発生することがわかる。
一方、pH 8.4の三之亟は、ラムネ泉よりも多い炭酸水素イオンHCO3-を含有していても、pHが高いので、
炭酸ガスが出ないことを示している。
ずいぶんと以前に、「温泉の化学」というものを書いたが、その中で述べた硫黄の七変化に負けるとも劣らない、CO2の七変化なのである。
さて、この炭酸系イオンがいかに多いかが、豆腐が溶けるかどうかに多大に影響してくるのである。
なお、郡司さんによると、この炭酸イオンの多さが、つるつるの良さに関係していると断言している。
この話は少々解説しないといけない。
「つるつる」の感触の元は、多くの人はケイ酸ナトリウムあるいはケイ酸水素ナトリウムからきていると思い込んでいる。が、郡司さんはそれはそうだが、入浴後に得られる爽快感はこの炭酸イオンのせいではないか、と考えているのだ。
化学的にどうかというと、ケイ酸イオンはある意味皮膚にとってはあまりよくないものなのだが、炭酸イオンは上述の七変化のおかげで、入浴後は炭酸ガスになるていどで、皮膚に残存することもなく、爽快感が得られるはずである。
すなわち、ケイ酸イオンが多くて、つるつる感がいい、といっても入浴後に残っていては、せっかくの美人の肌も荒れる可能性がある、ということかもしれない。この辺りは、ぜひ、化粧品会社の人と議論してみたいところだ。
脱線して申し訳ない・・・
硫酸イオンは邪魔者!
こうして役者は、pHと炭酸系の人々がそろえばいいか、というと話はそう簡単ではない。豆腐を溶かすどころか固める方に向かう、いわば邪魔者がいるのだ。
それが、硫酸イオンSO42-である。
豆腐をつくるときに、にがり(苦汁)を用いるが、この成分は、塩化マグネシウムと思われているが、実はそうではない。海水から苦汁をとると、硫酸マグネシウム、塩化マグネシウム、硫酸カルシウム、塩化カルシウムなどの混合物であり、これが豆腐をうまくする天然苦汁となる。
そう。温泉でも硫酸塩泉を、昔は「苦味泉」と言ったではないか。
ただ、生理学的実験(たばこ産業さん)の例もあるように、苦み自身は塩化マグネシウムの方がきついのかもしれない。
さて、この硫酸マグネシウムが、なぜ豆腐を作るのにいいのか、という点だ。
化学的に言えば、2価のマグネシウムイオンと、2価の硫酸イオンが、豆乳成分のたんぱく質の凝集に大きく寄与しているのである。
この凝集は、急速凝集とよばれ、物理化学的にはその速度は、Schulze-Hardyの急速凝集理論で説明できる。これは、塩析の効果をイオンの価数で整理したもので、同じ電解質濃度でも、イオンの価数が大きいと圧倒的に凝集速度が速くなる。この速度は、イオンの価数の6乗に比例する。
つまり、2価の硫酸イオンは、1価の塩化物イオンCl-の濃度の、2の6乗=64倍も、速く凝集させることができるのである。
陽イオン側では、1価のナトリウムイオンNa+よりも、2価のマグネシウムイオンMg2+ や、カルシウムイオン Ca2+を使う。こちらも64倍の効果がある。
豆腐がゆっくり凝集しているのでは話にならないので、こういう苦汁は大切なのだ。
牛乳が塩析で凝集したのは、バターであるが、こちらは十分に時間をかけるので、NaClで十分なのである。
したがって、2価のイオンである、硫酸イオン、マグネシウムイオン、それにカルシウムイオンは、豆腐が溶けるためには邪魔者なのである。
同様な理由でアルミニウムイオンもない方がよい。
三之亟
この観点から、実験では、同じ中山平の三之亟さんの湯を選んだのだ。
結果は、ここ「さらなる実験 その2 「嬉野温泉の泉質を追及」 ~三之亟湯~」を見てほしい。
予想通り、豆腐は相当に溶けた。
理由はいうまでもなく、上述の解説の通りである。
すなわち、pH、炭酸系イオンがいて、邪魔者の影響がなかったのだ。
だが、嬉野温泉豆腐とは何かが違った。それは何か。
(長くなったので、『ひとりごと その12 さらなる考察と解説 「中山平湯豆腐の完成は近い!」続編』に続きます)
|
|
|

