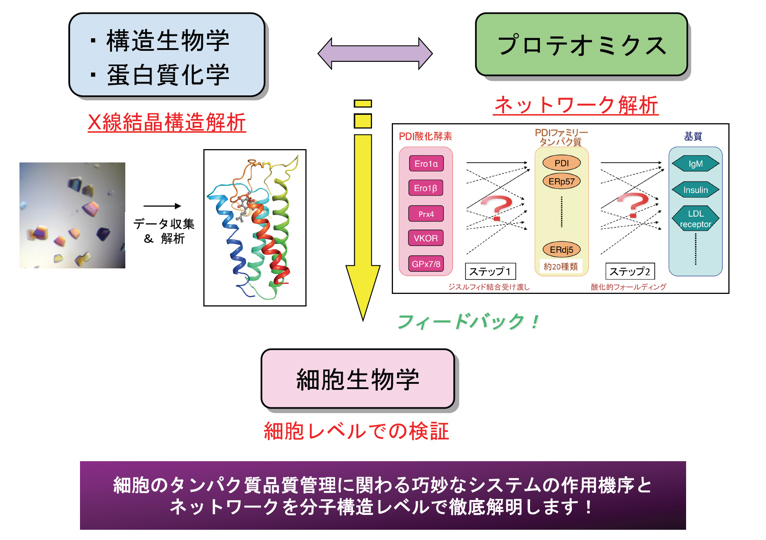
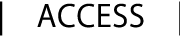研究内容
私たちは細胞が備える巧妙なタンパク質品質管理の仕組みを
分子構造レベルから細胞レベルまで広く研究しています!
タンパク質はN末端からC末端まで多くのアミノ酸が連なったポリペプチド鎖です。リボソームによって合成された直後のただの鎖の状態では機能は発揮されず、適切な場所にて正しい立体構造を形成して初めてタンパク質の独自の機能は発揮されます。最近の研究により、幾つかの細胞補助因子(分子シャペロン)がタンパク質の立体構造形成(フォールド)において重要な役割をしていることが分かってきました。一方で、細胞の中では誤った立体構造を形成し機能不全に陥るタンパク質が生じることもあります。これら不良品タンパク質が過剰に蓄積することは細胞にとって有害であり、病気にもつながるので、速やかに分解除去されなければなりません。我々は、これら細胞が兼ね備えるタンパク質の立体構造形成促進のためのシステムと不良品タンパク質の分解除去のためのシステムの作用機序を、構造生物学・生化学・プロテオミクス・細胞生物学的手法を駆使し、徹底的に研究しています。自分が世界で初めてこれを見つけた!解明した!という感動を味わうため、快適な研究環境にて是非一緒に頑張りましょう!
もっと詳しく知りたい人のために
国内外で活発に研究が進められている“小胞体品質管理”の仕組み
タンパク質の高次構造形成を促し、構造異常タンパク質を排除することは、いわば細胞内のタンパク質の品質を管理するということです。あらゆる細胞内小器官のなかでも、小胞体におけるタンパク質品質管理機構に関する研究が国内外で活発に研究が進められています。小胞体は、細胞内で産生される全タンパク質の約30%を占める分泌タンパク質や膜タンパク質が合成される重要な区画です。ここで合成された新規ポリペプチド鎖は、糖鎖修飾やジスルフィド結合(次章参照)の形成を介して、正しい立体構造形成が促進されます。そして正しくフォールドしたタンパク質のみ選択的に下流の定められた区画に分泌されます。正しい立体構造が形成されなかった(ミスフォールドした)タンパク質についても、ひとまずは幾つかの補助因子が協力し合い立体構造の修復が試みられます。その代表的なものがカルネキシンサイクルと呼ばれるものです(略 詳細)。これによっても立体構造が修復されない場合、小胞体関連分解と呼ばれる機構によりサイトゾルへ送り返され、ユビキチン・プロテアソームシステムにより分解されます(図1参照)。
ジスルフィド結合とタンパク質品質管理
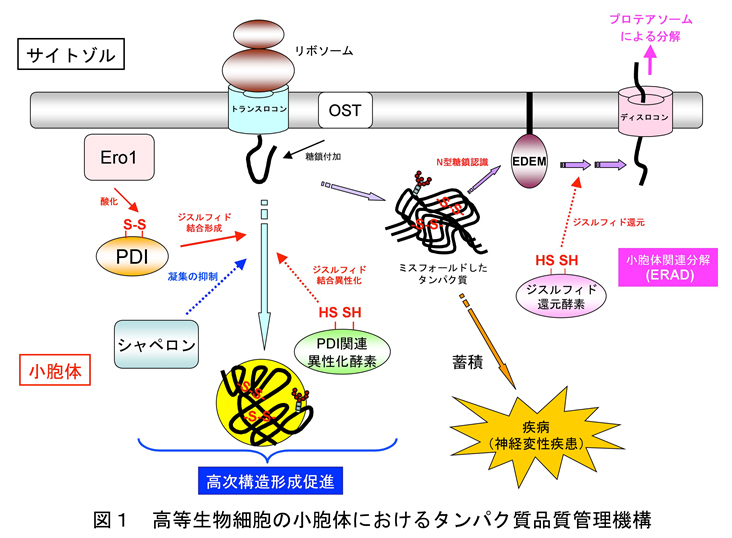
ここでタンパク質の高次構造形成(フォールド)について、少し化学的な視点から考えてみます。出来上がったタンパク質の立体構造内部を眺めると、水素結合、静電相互作用、疎水性相互作用など多くの相互作用がアミノ酸間で働いていることが分かります。そのなかで、ジスルフィド結合と呼ばれる二つのシステインのチオール基が二電子酸化を受けることにより形成される硫黄原子間の共有結合(図2)は、その強固さが故、タンパク質の立体構造を安定化する上で非常に重要な役割を担っています。実際、細胞の外に分泌されるタンパク質の多くはジスルフィド結合を有しています。これは、細胞外は膜に包まれた細胞内部に比べ物理的にも化学的にもより過酷な環境であるが故、タンパク質の構造をより頑強にする必要があるためと考えられています。一方で、ジスルフィド結合は本来架かるべきシステイン間ではなく、誤ったシステイン間で形成されることもあります。当然ながらこの場合、タンパク質のミスフォールドが誘起されることになり、立体構造を修復するためにはジスルフィド結合の組換えが必要になります。さらには、誤ったジスルフィド結合を開裂(還元)することでタンパク質の立体構造を解きほぐし、より分解除去されやすい形にすることもあります。このように、ジスルフィド結合の形成・異性化・開裂は、細胞におけるタンパク質の品質管理さらには運命を決定する重要要素であると言えます。
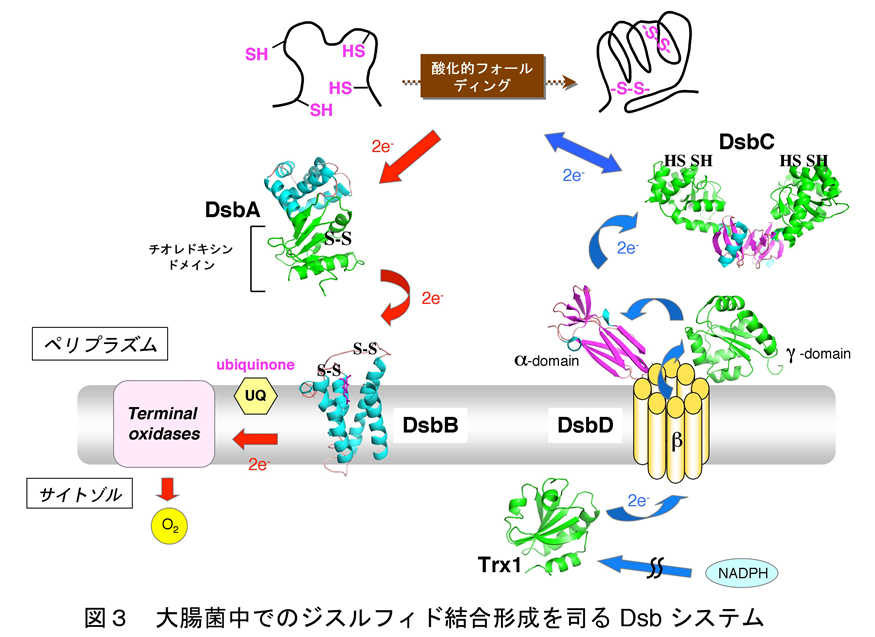
細胞のジスルフィド結合形成の仕組み(大腸菌の場合)
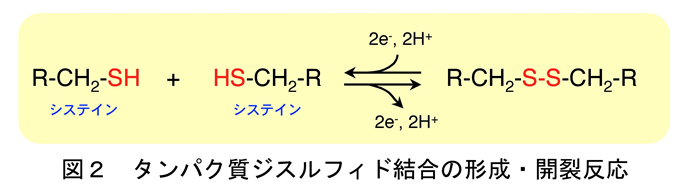
近年の研究により、ほとんど全ての細胞はジスルフィド結合を効率よく導入するための触媒システムを備えていることが判明しております。その中でも、大腸菌におけるジスルフィド結合形成システムに関する研究が最も進んでおり、我々もこれに大きく貢献しました。大腸菌では、主として内膜と外膜の間のペリプラズムと呼ばれる空間においてジスルフィド結合の形成は進みます。ペリプラズムにはDsb (Disulfide bond)因子と呼ばれる一連の酵素群が存在し、これら酵素が協同的にはたらくことによりジスルフィド結合の形成を伴う酸化的なフォルーディングが効率よく進行します。
具体的には図3に示すように、ジスルフィド結合導入酵素としてDsbAが機能し、基質を酸化し還元型となったDsbAのシステインペアは内膜蛋白質DsbBにより再酸化されます。DsbBが受け取った電子は呼吸鎖成分であるユビキノン (UQ) に受け渡され、最終的にはユビキノール酸化酵素を介して酸素が電子受容体となることが分かっています。DsbAはジスルフィド結合導入酵素としては優れているのですが、ときに誤ったシステインペアにジスルフィド結合を導入することもあります。そこで大腸菌は、誤ったジスルフィド結合を組み替えるべくジスルフィド異性化酵素DsbCも持ち合せていることが分かっています。DsbCが異性化酵素として機能するためには、酸化酵素であるDsbAとは逆に、その活性部位は還元型に保たれていなければなりません。その還元力の源はサイトゾルに存在するチオレドキシンシステムに由来しており、チオレドキシンからの還元力は内膜タンパク質DsbDを介してDsbCへ受け渡されます。
細胞のジスルフィド結合形成の仕組み(真核細胞の場合)
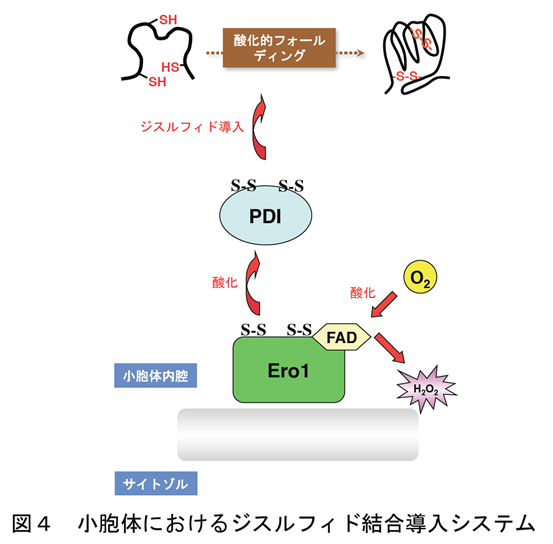
ジスルフィド結合を効率よく導入するためのシステムは、大腸菌などの原核細胞にとどまらず、真核細胞にもちゃんと存在します。特に分泌蛋白質の合成の場である小胞体には、ジスルフィド結合導入のための酸化経路が確立されていることが知られています。図4に示すように、小胞体にはジスルフィド結合導入酵素としてProtein Disulfide Isomerase (PDI)が存在し、またその再酸化因子としてEro1が存在します。 大腸菌のシステムはユビキノンを酸化力の源にしているのに対し、小胞体のシステムはFAD(Flavin Adenine Dinucleotide)の酸化力を利用しています。つまり、大腸菌におけるDsbA-DsbB-ユビキノンと小胞体のPDI-Ero1-FADは互いに機能的ホモログの関係にあります。
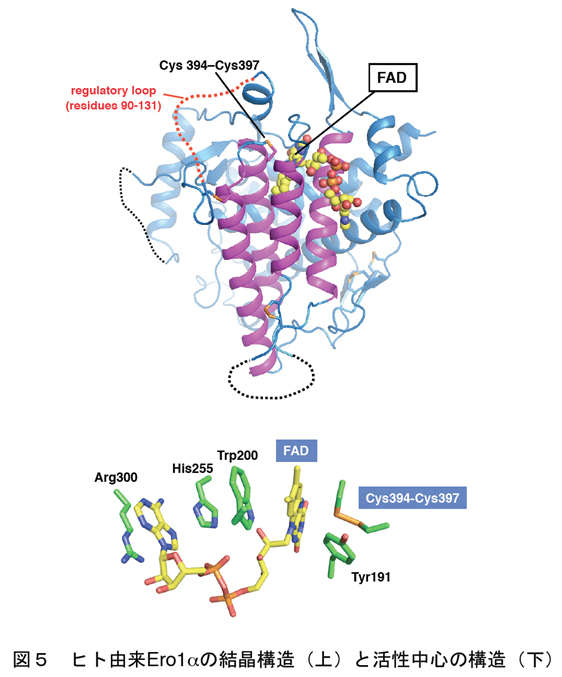
真核細胞のPDI-Ero1酸化システムに関する研究は、出芽酵母の系を中心に大きな発展をとげましたが、最近ではヒト細胞における同システムの研究も大きな進展をみせております。特に昨年、我々はヒト細胞の小胞体内でジスルフィド結合を創りだすフラビン酵素Ero1aの結晶構造を解くことに成功し(図5;Inaba* et al., EMBO J, 2010)、これによりEro1aによるPDI酸化の作用機序の理解が大きく進みました。ここで重要なこととして、Ero1はPDIを酸化する際、活性酸素種の一つである過酸化水素を副産物としてだすため、あまり働き過ぎないよう自身の活性を調節していることが報告されています。我々はヒトEro1aの高活性状態および不活性状態両方の結晶構造を解き、Ero1aの活性調節の分子機構をも明らかにしました。これにより小胞体におけるレドックス恒常性維持の機構の一端が分子構造レベルで明らかになったと言えます。
高等動物細胞におけるジスルフィド結合形成ネットワーク
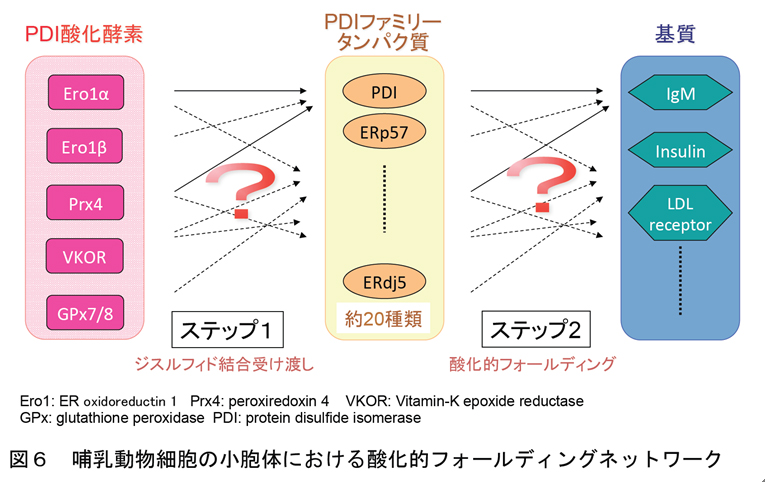
酵母ではEro1pを欠損させると酸化的フォールディングが進まず構造異常タンパク質が蓄積し、小胞体ストレスが生じた結果、細胞死に至ります。したがって、酵母ではほぼ間違いなくEro1p-PDI経路が主たるジスルフィド結合形成経路と考えられます。しかし興味深いことに、哺乳動物ではEro1α、βダブルノックアウトをしてもマウスは正常に発生・生育し、さらにはIgMの酸化的フォールディングにも全く影響が見られないことが、2011年にDavid Ron博士らのグループにより報告されました。この結果から、哺乳動物にはEro1-PDI経路以外のジスルフィド結合形成経路が存在することが強く示唆されたと言えます。実際、この報告と前後して哺乳動物にはEro1以外のPDIファミリータンパク質に対して酸化能を持つ4種類の酸化酵素(Prx4, VKOR, Gpx7/8)が相次いで報告されました。またPDIファミリーの酵素についても、哺乳動物細胞では20種類以上存在することが知られています。以上の知見から、哺乳動物細胞には当初考えられていたよりもはるかに複雑なジスルフィド結合形成のためのネットワークが存在するであろうと考えられるに至っています(図6)。しかしながら、それらネットワークの詳細と各経路の機能的役割は未だ不明な点が多く残っており、この網羅的な解析が残された重要課題です!
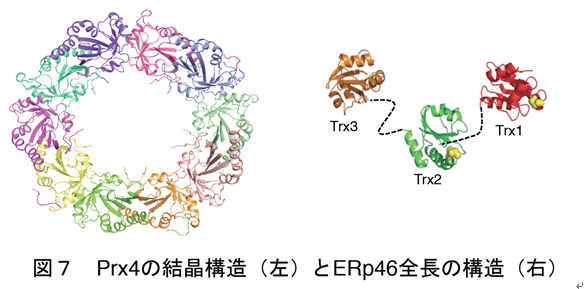
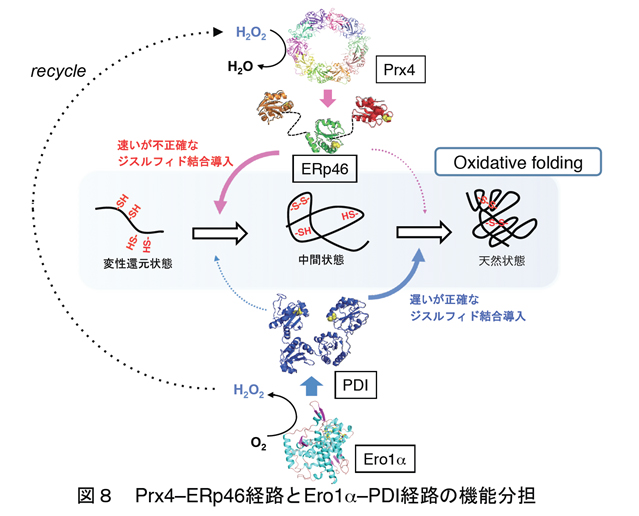
上記のジスルフィド結合形成のためのネットワークについて、少なくともEro1αとPrx4を起点とした経路の機能的役割はかなり分かってきました。Ero1αがPDIを特異的に認識し酸化するのに対し、Prx4は細胞内でも細胞外の実験においてもERp46とP5を特異的に酸化することが分かりました。我々の結晶構造解析より、Prx4がドーナツ状の美しい十量体構造をとることが分かりました(図7)。一方ERp46は、それを構成する三つのチオレドキシン様ドメイン(Trx1, Trx2, Trx3)の構造をX線結晶構造解析により決定し、またX線小角散乱法による解析からERp46の全長構造モデルを構築しました(図7)。これにより、ERp46が他のPDIファミリータンパク質にはみられない新規な「開いたV字構造」をとることが明らかとなりました。
Bovine Pancreas Trypsin Inhibitor (BPTI)をモデル基質として用い、HPLCによる酸化的フォールディング解析を行った結果、ERp46は正確さには欠けるものの迅速にジスルフィド結合を導入するのに対し、PDIが触媒する反応では、時間はかかるものの、天然型のジスルフィド結合が正確に導入されることが分かりました。さらに、ERp46とPDIが協同的に働くことにより、天然型への正しい酸化的フォールディング反応が相乗的に加速されることを我々は発見しました(図8)。哺乳動物細胞の小胞体では、複数の酸化還元経路が機能分担しながら精巧なネットワークシステムを構成し、そのことがジスルフィド結合を有する多くの分泌タンパク質・膜タンパク質の効率的な産生につながると考えられます。細胞内における他のPDIファミリー酵素の基質特異性や酸化還元パートナータンパク質の同定など、今後さらなる解明が待たれます。
小胞体関連分解を促すジスルフィド還元酵素ERdj5
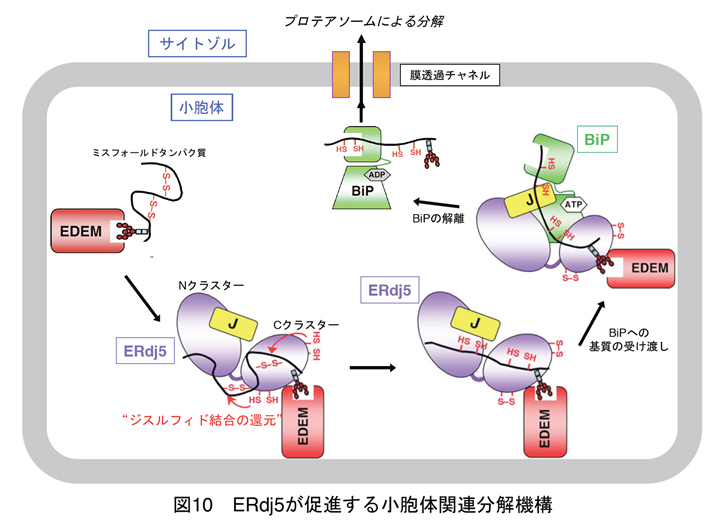
興味深いことに、小胞体の中にはジスルフィド結合形成のための酸化経路に加え、ジスルフィド結合開裂のための還元経路も存在することが分かってきました。その代表的な因子が2008年に永田和宏教授のグループにより報告されたERdj5と呼ばれる酵素です(Ushioda et al., Science, 2008)。ERdj5はミスフォールドしたタンパク質の誤ったジスルフィド結合を特異的に還元することで構造を解きほぐし、サイトゾルへの膜を介した逆輸送さらにはプロテアソームによる分解を受けやすい形にすることで、小胞体中の異常蛋白質の分解除去(小胞体関連分解)を促すと考えられています。
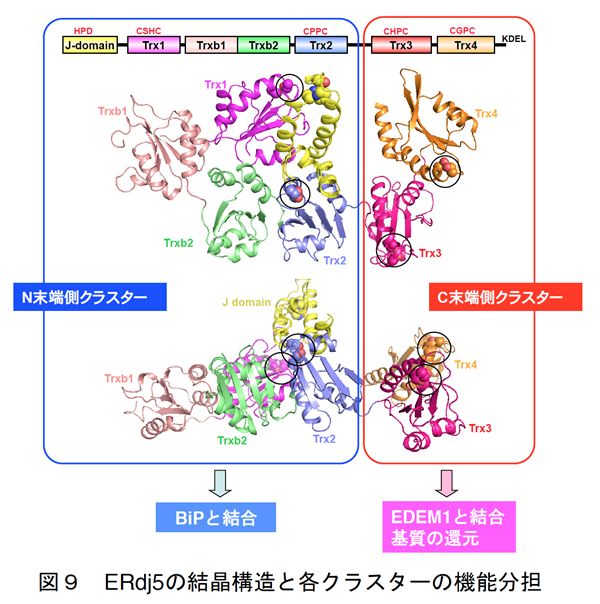
我々はERdj5が駆動する小胞体関連分解経路の作用機序を解明する目的で、ERdj5の結晶構造解析にも果敢に挑みました。ERdj5は分子量が~90 kDaにもおよぶPDIファミリー最大のマルチドメインタンパク質であり、その結晶化は容易ではありませんでした。しかしながら徹底したサンプル調整条件および結晶化条件の検討により、ERdj5の結晶構造解析にも成功するに至りました(図9)。
得られた構造情報を基に系統的な機能解析実験を進め、図10に示すERdj5およびそのパートナータンパク質であるEDEMおよびBiPに依存した小胞体関連分解機構モデルを提唱するに至りました。以上の研究をとおし、小胞体内で生じたミスフォールドタンパク質の認識、還元、受け渡しという一連のイベントを分子構造レベルで正確に記述できました。
小胞体—ゴルジ体間のpH勾配を利用した新たなタンパク質品質管理機構の発見!
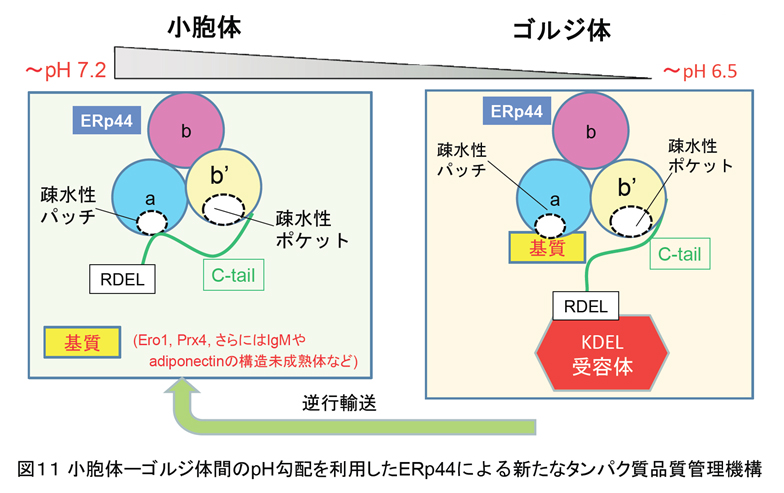
タンパク質品質管理機構はジスルフィド結合の形成・組換え・開裂を介したものだけでなく、様々な機構により司られていることも分かってきました。前述したように、小胞体は分泌タンパク質や膜タンパク質が高次構造を形成する場となるオルガネラです。正しい立体構造を獲得したタンパク質は分泌経路にそってゴルジ体を経由したのち,それぞれ指定の区画へと輸送されます。しかし一方で、小胞体に局在すべきタンパク質や高次構造上未成熟な分泌タンパク質はゴルジ体からCOPI被覆小胞を介して小胞体へ逆輸送されます。この逆輸送経路において、PDIファミリータンパク質の一つであるERp44がそれら小胞体局在タンパク質や構造未成熟のタンパク質を選択的に認識・捕獲し,KDEL受容体との結合を介して小胞体へ逆輸送することが知られています。我々は最近、この機構において小胞体とゴルジ体間に存在するpH勾配が極めて重要な役割を担うことを明らかにしました。すなわち、ERp44はこのpH勾配を何らかの機構によりセンスし、C末端テール領域の開閉を介して、逆輸送すべき基質との結合解離を制御することが解明されました(図11)。
今後の研究が大事です!!
〜さらなるタンパク質品質管理機構の発見を目指して〜
以上のように、大腸菌から高等生物細胞までタンパク質品質管理に関わるシステムの研究が目覚ましく進展し、構造情報を基に分子機構の詳細さえも多く語れるようになってきました(我々も十分にこれに貢献しました)。しかしながら、まだ我々は細胞の巧妙なシステムのほんの一端を解明したに過ぎません。細胞にはもっと多くのタンパク質の恒常性維持のためのネットワークが張り巡らされています。例えば、細胞内で合成される全タンパク質の約50%は何らかの金属イオンと結合していますが、各オルガネラにはそれら金属イオンの濃度を厳密に調整する仕組みも存在します。また、細胞内でタンパク質はリボソームによって合成されますが、リボソーム上での翻訳とカップルした新生ポリペプチド鎖の高次構造形成がタンパク質およびメッセンジャーRNAの品質管理において重要な意味をもつことも分かってきました。これらシステムが状況に応じて互いに連係プレーをとることで、細胞の品質は保たれているのです。高等生物細胞になればなるほどこれに関わる因子は増え、より複雑となり、未知なる領域が多く残されています。細胞が備えるこれらタンパク質品質管理機構の解明は、ミスフォールド蛋白質や細胞ストレスが引き起こす様々な疾患の治療にも将来的にはつながり、その医学的貢献は計り知れません。今後も本研究室では、構造生物学(分子機構)・生化学(定量的各論)・プロテオミクス(全体像)・細胞生物学(真の機能の検証)を軸とした多角的アプローチにより、これら重要課題を徹底的に解明したいと考えています。皆さんの参加を心よりお待ちしています!